Công thức oxit cao nhất của Crom (Cr)
Bài viết công thức oxit cao nhất của crom, Cr (hay công thức oxide cao nhất của Chromium) có đầy đủ nội dung về công thức oxit cao nhất, kiến thức mở rộng, tính chất hóa học và bài tập vận dụng về oxit cao nhất của Cr. Mời các bạn theo dõi:
Công thức oxit cao nhất của Crom (Cr)
I. Công thức oxit cao nhất của Cr
Công thức oxide cao nhất của chromium là: CrO3.
Giải thích:
Cr (Z = 24) có cấu hình electron là: 1s22s22p63s23p63d54s1.
⇒ Chromium thuộc nhóm VIB trong bảng tuần hoàn, có hoá trị cao nhất với oxygen là VI.
Do đó, công thức oxide cao nhất của chromium là: CrO3.
II. Mở rộng kiến thức về CrO3
1. Tính chất vật lý và nhận biết
- Tính chất vật lí: CrO3 là chất rắn màu đỏ thẫm, tan được trong nước.
- Nhận biết: Tan được trong dung dịch NaOH, cho dung dịch màu vàng.
2NaOH + CrO3 → Na2CrO4 + H2O
2. Tính chất hóa học
- CrO3 mang tính chất hóa học của acidic oxide, có tính oxi hóa mạnh.
a. Tính chất của acidic oxide
+ Tác dụng với nước:
CrO3 + H2O → H2CrO4 (chromic acid)
2CrO3 + H2O → H2Cr2O7 (dichromic acid)
+ Tác dụng với dung dịch base:
2NaOH + CrO3 → Na2CrO4 + H2O
b. Tính oxi hóa mạnh
+ Một số chất hữu cơ và vô cơ (S, P, C, C2H5OH) bốc cháy khi tiếp xúc với CrO3
2NH3 + 2CrO3 → 3H2O + N2 + Cr2O3
3S + 4CrO3 → 3SO2 + 2Cr2O3
+ Là chất kém bền
4CrO3 → 2Cr2O3 + 3O2
3. Điều chế
- Cho H2SO4 đặc tác dụng với dung dịch bão hòa potassium chromate hoặc potassium dichromate.
K2Cr2O7 + 2H2SO4 → 2KHSO4 + 2CrO3 + H2O
4. Ứng dụng
- Cr2O7 được sử dụng trong mạ chromium. Nó thường được sử dụng với các chất phụ gia có ảnh hưởng đến quy trình mạ.
- Cr2O7 phản ứng với cadmium, kẽm và kim loại khác để thụ động hóa chromium giúp chống lại sự ăn mòn.
- Cr2O7 cũng được sử dụng trong sản xuất hồng ngọc tổng hợp.
- Cr2O7 là giải pháp cũng được sử dụng trong việc áp dụng phủ sơn anode lên nhôm, được ứng dụng trong hàng không vũ trụ.
III. Bài tập vận dụng liên quan
Câu 1: Phản ứng nào sau đây không đúng?
Hướng dẫn giải:
Đáp án D
CrO3 là chất có tính oxi hóa mạnh nên không phản ứng với SO3.
Câu 2: Ở trạng thái cơ bản nguyên tử chromium có
A. 3 electron độc thân.
B. 4 electron độc thân.
C. 5 electron độc thân.
D. 6 electron độc thân.
Hướng dẫn giải:
Đáp ánD
Cấu hình electron của chromium là: [Ar]3d54s1 ⇒ Có 6 electron độc thân ở trạng thái cơ bản.
Câu 3:Một oxide của nguyên tố R có các tính chất sau
- Tính oxi hóa rất mạnh.
- Tan trong nước tạo thành hỗn hợp dung dịch H2RO4 và H2R2O7.
- Tan trong dung dịch kiềm tạo thành anion RO42- có màu vàng. Oxide đó là
A. SO3.
B. CrO3.
C. Cr2O3.
D. Mn2O7.
Hướng dẫn giải:
Đáp án B
- Oxide CrO3 có tính oxi hóa rất mạnh.
- Cr2O3 tan trong nước tạo thành hỗn hợp dung dịch H2CrO4 và H2Cr2O7
CrO3 + H2O → H2CrO4 (chromic acid)
2CrO3 + H2O → H2Cr2O7 (dichromic acid)
- CrO3 tan trong dung dịch kiềm tạo thành ion RO42- có màu vàng.
CrO3 + 2NaOH → Na2CrO4 + H2O
Xem thêm Công thức oxit cao nhất hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

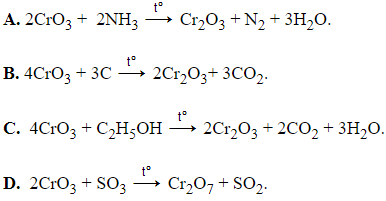





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



