Đồng vị của Astatine (At) (chi tiết nhất)
Bài viết đồng vị của Astatine hay đồng vị của At chi tiết nhất giúp học sinh các cấp có thêm thông tin về đồng vị của At từ đó học tốt môn Hóa hơn.
Đồng vị của Astatine (At) (chi tiết nhất)
Cho đến năm 2020, đã có 118 nguyên tố hóa học được xác định, trong đó có 94 nguyên tố có nguồn gốc tự nhiên, còn lại là nguyên tố nhân tạo. Mỗi nguyên tố hóa học đều có nhiều đồng vị, bài viết sau sẽ cung cấp cho các em kiến thức về đồng vị của astatine.
I. Đồng vị của astatine
- Tất cả các đồng vị của astatine đều tồn tại trong thời gian ngắn; ổn định nhất là astatine-210, với chu kỳ bán rã là 8.1 giờ.
- Nguyên tử khối trung bình của astatine được tính như sau:
II. Kiến thức mở rộng
1. Ứng dụng của một số đồng vị
- Các đồng vị ổn định nhất astatine-210 và astatine-211 mà hữu ích về mặt y tế, đều không tồn tại trong tự nhiên; chúng chỉ có thể được sản xuất tổng hợp, thường bằng cách bắn phá bismuth-209 bằng các hạt alpha.
2. Công thức tính nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị, có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
X, Y, Z …: lần lượt là số khối của các đồng vị.
x, y, z… là phần trăm số nguyên tử của các đồng vị tương ứng.
III. Bài tập minh họa
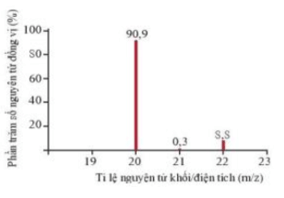
Câu 1: Phổ khối, hay phổ khối lượng chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như hình dưới. Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích Z của các ion đồng vị neon đều bằng +1). Tính nguyên tử khối trung bình của neon.
A. 20,179.
B. 20,344.
C. 20,388.
D. 20,791.
Hướng dẫn giải
Đáp án đúng là: A
Câu 2. Nguyên tử khối trung bình của chlorine (Cl) là 35,5. Chlorine có hai đồng vị bền là 37Cl và 35Cl (Biết nguyên tử khối của K là 39, O là 16). Phần trăm khối lượng của 37Cl trong KClO3 gần nhất với
A. 28,57%.
B. 7,55%.
C. 8,55%.
D. 21,43%.
Hướng dẫn giải
Đáp án đúng là: B
Câu 3: Bromine có hai đồng vị là 79Br và 81Br. Tỉ lệ số nguyên tử của hai đồng vị này là 27: 23. Tính nguyên tử khối trung bình của bromine.
A. 80,00.
B. 79,92.
C. 79,00.
D. 79,09.
Hướng dẫn giải
Đáp án đúng là: B
Xem thêm các bài viết về đồng vị của các nguyên tố hóa học hay khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



