Đồng vị của Hydrogen (H) (chi tiết nhất)
Bài viết đồng vị của Hydrogen hay đồng vị của H chi tiết nhất giúp học sinh các cấp có thêm thông tin về đồng vị của H từ đó học tốt môn Hóa hơn.
Đồng vị của Hydrogen (H) (chi tiết nhất)
Cho đến năm 2020, đã có 118 nguyên tố hóa học được xác định, trong đó có 94 nguyên tố có nguồn gốc tự nhiên, còn lại là nguyên tố nhân tạo. Mỗi nguyên tố hóa học đều có nhiều đồng vị, bài viết sau sẽ cung cấp cho các em kiến thức về đồng vị của hydrogen.
I. Đồng vị của Hydrogen
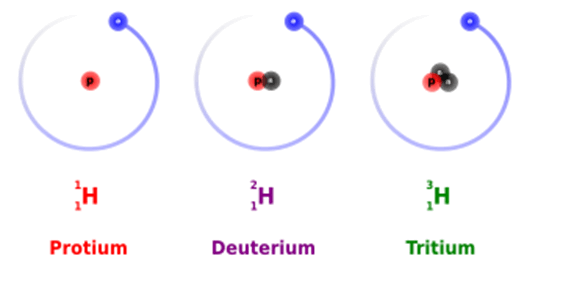
- Ba đồng vị ổn định nhất của hydrogen là protium (); deuterium ( hay ); tritium ( hay ).
- Trong 3 đồng vị ổn định nhất của hydrogen thì đồng vị tritium ( hay ) tồn lại dưới dạng vết, hai đồng vị còn lại được tìm thấy trong tự nhiên với hàm lượng như sau:
|
Đồng vị |
Nguồn tự nhiên |
Chu kỳ bán rã |
Kiểu phân rã |
Năng lượng phân rã (MeV) |
Sản phẩm phân rã |
|
99,985% |
Bền |
||||
|
0,015% |
Bền |
||||
- Nguyên tử khối trung bình của hydrogen được tính như sau:
- Ngoài 3 đồng vị ổn định, hydrogen còn có các đồng vị kém bền, không tìm thấy trong tự nhiên là .
II. Kiến thức mở rộng
1. Ứng dụng của một số đồng vị
- Deuterium không phải là chất phóng xạ và không phải là mối nguy hiểm độc hại đáng kể. Nước giàu deuterium được gọi là nước nặng. Deuterium và các hợp chất của nó được sử dụng làm nhãn không phóng xạ trong các thí nghiệm hóa học và trong dung môi cho phép đo phổ cộng hưởng từ hạt nhân 1H . Nước nặng được sử dụng làm chất làm chậm neutron và chất làm mát cho lò phản ứng hạt nhân. Deuterium cũng là nhiên liệu tiềm năng cho phản ứng tổng hợp hạt nhân thương mại.
- Tritium có thể được sử dụng trong các thí nghiệm đánh dấu hóa học và sinh học như một chất đánh dấu phóng xạ.
2. Công thức tính nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị, có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
X, Y, Z …: lần lượt là số khối của các đồng vị.
x, y, z… là phần trăm số nguyên tử của các đồng vị tương ứng.
III. Bài tập minh họa
Câu 1: Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là chiếm 73% và . Nguyên tử khối trung bình của nguyên tố Cu là
A. 63,54.
B. 64,54.
C. 64,00.
D. 64,50.
Hướng dẫn giải
Đáp án đúng là: A
Áp dụng công thức tính nguyên tử khối trung bình là có:
Câu 2. Chlorine có hai đồng vị bền trong tự nhiên, trong đó có một đồng vị là 35Cl chiếm 77,5% số nguyên tử. Biết nguyên tử khối trung bình của chlorine là 35,45. Đồng vị còn lại là
A. 37Cl.
B. 36Cl.
C. 38Cl.
D. 39Cl.
Hướng dẫn giải
Đáp án đúng là: A
Gọi đồng vị còn lại của chlorine là ACl, chiếm: 100% - 77,5% = 22,5% (số nguyên tử).
Nguyên tử khối trung bình của chlorine là 35,45.
→ → A = 37.
→ Đồng vị còn lại là 37Cl.
Câu 3: Biết rằng khí hiếm argon (kí hiệu Ar) có 3 đồng vị: (0,3%); (0,06%); (99,6%). Nguyên tử khối trung bình của argon là
A. 38,97.
B. 39,97.
C. 37,97.
D. 39,97.
Hướng dẫn giải
Đáp án đúng là: B
Xem thêm các bài viết về đồng vị của các nguyên tố hóa học hay khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



