C4H10 → C3H6 + CH4 | Butan ra propene và methane
Phản ứng cracking butan tạo ra propene và methane hay C4H10 tạo ra C3H6 và CH4 đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C4H10 có lời giải, mời các bạn đón xem:
C4H10 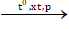 C3H6 + CH4
C3H6 + CH4
1. Phương trình phản ứng butan ra propilen
CH3 – CH2 – CH2 – CH3 CH2 = CH – CH3 + CH4
2. Hiện tượng của phản ứng butan ra propilen
- Sản phẩm thu được làm mất màu dung dịch brom ở điều kiện thường.
3. Cách tiến hành phản ứng butan ra propilen
- Đem khí butan (C4H10) đun nóng ở nhiệt độ cao, có xúc tác Ni, Fe.
4. Mở rộng về tính chất hoá học của alkane
- Ở nhiệt độ thường, các alkane không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa như dung dịch KMnO4 (thuốc tím)...
- Khi chiếu sáng hoặc đun nóng, các alkane dễ dàng tham gia các phản ứng thế, phản ứng tách hiđro và phản ứng cháy.
4.1. Phản ứng thế bởi halogen
- Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử methane.
Phương trình hóa học:
CH4 + Cl2 CH3Cl + HCl
CH3Cl + Cl2 CH2Cl2 + HCl
CH2Cl2 + Cl2 CHCl3 + HCl
CHCl3 + Cl2 CCl4 + HCl
- Các đồng đẳng của methane cũng tham gia phản ứng thế tương tự methane.
Nhận xét:
- Nguyên tử hiđro liên kết với nguyên tử cacbon bậc cao hơn dễ bị thế hơn nguyên tử hiđro liên kết với nguyên tử cacbon bậc thấp hơn.
4.2. Phản ứng tách
- Dưới tác dụng của nhiệt và chất xúc tác thích hợp, các alkane có phân tử khối nhỏ bị tách hiđro thành hydrocarbon không no tương ứng.
Thí dụ:
CH3 – CH3 CH2 = CH2 + H2
- Ở nhiệt độ cao và chất xúc tác thích hợp, ngoài việc bị tách hiđro, các alkane còn có thể bị phân cắt mạch cacbon tạo thành các phân tử nhỏ hơn.
Thí dụ:
CH3 – CH2 – CH3
4.3. Phản ứng oxi hóa
- Khi bị đốt, các alkane đều cháy, tỏa nhiều nhiệt.
CnH2n + 2 + O2 nCO2 + (n + 1)H2O
5. Bài tập vận dụng liên quan
Câu 1: Thực hiện phản ứng đề hiđro hóa một hydrocarbon M thuộc dãy đồng đẳng của methane thu được một hỗn hợp gồm H2 và 3 hydrocarbon N, P, Q. Đốt cháy hoàn toàn 4,48 lít khí N hoặc P, hoặc Q đều thu được 17,92 lít CO2 và 14,4 gam H2O (thể tích các khí ở đktc). Công thức cấu tạo của M là
A. CH3-CH2-CH2-CH2-CH3
B. CH3-CH(CH3)2
C. CH3-CH2-CH(CH3)2
D. CH3-CH2-CH2-CH3
Hướng dẫn giải:
Đáp án D
Ta thấy: => hydrocarbon N là alkene
CnH2n + O2 → CO2 + nH2O
0,2 0,8
=> 0,2n = 0,8 => n = 4 => alkene là C4H8
=> N, P, Q là các đồng phân của nhau và cùng CTPT là C4H8
Khi đốt cháy N hoặc P hoặc Q đều cho số mol CO2 và H2O giống nhau
CH3-CH2-CH2-CH3 (1) CH3-CH(CH3)-CH3 (2)
Trong 2 đồng phân trên chỉ có (1) tách hiđro cho 3 sản phẩm là đồng phân của nhau
CH3-CH2-CH2-CH3 → CH3-CH=CH-CH3 + H2
(cis-trans)
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2
Câu 2: Khi cracking hoàn toàn một thể tích alkane X thu được ba thể tích hỗn hợp Y (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất); tỉ khối của Y so với H2 bằng 12. Công thức phân tử của X là
A. C2H6
B. C3H8
C. C4H10
D. C5H12
Hướng dẫn giải:
Đáp án D
Giả sử cracking 1 mol alkane X thu được 3 mol hỗn hợp Y.
MY =12.2= 24 → mY = 3. 24 = 72 gam
Bảo toàn khối lượng: mX = mY = 72g
→ MX = 72 → 14n + 2 = 72 → n = 5
X là C5H12.
Câu 3: Cracking 8,8 gam propane thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propane chưa bị cracking. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là:
A. 39,6.
B. 23,16.
C. 2,315.
D. 3,96.
Hướng dẫn giải:
Đáp án B
Gọi số mol của C3H8 phản ứng là a và số mol của C3H8 dư là b mol
→ a = 0,18; b = 0,02.
Số mol A = 2a + b = 0,38
Mtb = 8,8 : 0,38 = 23,16
Câu 4: cracking n-butan thu được 35 mol hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần butan chưa bị cracking. Giả sử chỉ có các phản ứng tạo ra các sản phẩm trên. Cho A qua bình nước brom dư thấy còn lại 20 mol khí. Nếu đốt cháy hoàn toàn A thì thu được x mol CO2. Hiệu suất phản ứng tạo hỗn hợp A và giá trị của x là
A. 57,14%; 70
B. 75,00%; 80
C. 57,14%; 80
D. 75,00%; 70
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng:
C4H10 → CH4 + C3H6 (1)
C4H10 → C2H6 + C2H4 (2)
C4H10 → H2 + C4H8 (3)
Từ phương trình phản ứng, ta thấy:
Khi cho hỗn hợp A qua bình dựng brom dư thì chỉ có C3H6, C2H4, C4H8 phản ứng và bị giữ lại trong bình chứa brom. Khí thoát ra khỏi bình chứa brom là H2, CH4, C2H6, C4H10 dư nên suy ra:
Từ (*) và (**) ta có: a = 15 và b = 5
Đốt cháy A cũng như đốt cháy lượng C4H10 ban đầu sẽ thu được lượng CO2 như nhau
Bảo toàn C:
Câu 5: Khi tiến hành cracking 22,4 lít khí C4H10 (đktc) thu được hỗn hợp A gồm CH4, C2H6, C2H4, C3H6, C4H8, H2 và C4H10 dư. Đốt cháy hoàn toàn A thu được x gam CO2 và y gam H2O. Giá trị của x và y tương ứng là
A. 44 và 18.
B. 44 và 72.
C. 176 và 90.
D. 176 và 180
Hướng dẫn giải:
Đáp án C
Coi đốt cháy hoàn toàn A chính là đốt cháy C4H10 ban đầu
1 4 5 mol
→ x = 4.44 = 176 và y = 5.18 = 90
Câu 6: Cho etan qua xúc tác (ở nhiệt độ cao) thu được một hỗn hợp X gồm etan, etilen, acetylene và H2. Tỉ khối của hỗn hợp X đối với etan là 0,4. Nếu cho 0, 4 mol hỗn hợp X qua dung dịch Br2 dư thì số mol Br2 đã phản ứng là
A. 0,16 mol
B. 0, 24 mol
C. 0,32 mol
D. 0,40 mol
Hướng dẫn giải:
Đáp án B
Ta có: mtrước = msau phản ứng
H2 tách ra được thay bằng Br2 → nBrom = 0,24 (mol)
Câu 7: Cracking 40 lít n-butan thu được 56 lít hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần n-butan chưa bị cracking (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Giả sử chỉ có các phản ứng tạo ra các sản phẩm trên. Hiệu suất phản ứng tạo hỗn hợp A là
A. 40%
B. 50%
C. 60%
D. 70%
Hướng dẫn giải:
Đáp án A
Coi tỉ lệ về thể tích cũng là tỉ lệ về số mol
Câu 8: Khi cracking hoàn toàn một alkane X thu được hỗn hợp Y (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất ); tỉ khối của Y so với H2 bằng 14,5. Công thức phân tử của X là
A. C3H8
B. C4H10
C. C5H12
D. C2H6
Hướng dẫn giải:
Đáp án B
MY = 14,5.2 = 29
Câu 9: Thực hiện phản ứng cracking 11,2 lít butan ( đkc) thu được hỗn hợp A gồm các alkane và alkene. Trong hỗn hợp A chứa 4,35g chất X mà khi đốt cháy thu được 6,72 lít CO2 và 6,75g H2O . Hiệu suất phản ứng cracking là
A. 70%
B. 75%
C. 80%
D. 85%
Hướng dẫn giải:
Đáp án D
nbutan = 0,5 (mol);
Do số mol nước lớn hơn số mol CO2 nên X là alkane
→ nalkane = 0,075 (mol), alkane đó là C4H10
nbutan phản ứng = 0,5 - 0,075 = 0,425 (mol)
Câu 10: Một hỗn hợp X gồm hai alkane A, B đồng đẳng kế tiếp. Cracking 11,2 lít (đktc) hỗn hợp X thu được 22,4 lít hỗn hợp Y (đktc) gồm alkane, alkene và H2, tỉ khối hơi của Y đối với H2 là 8,2. Vậy công thức phân tử và số mol của A, B lần lượt là:
A. C3H8 (0,2 mol); C4H10 (0,3 mol).
B. C2H6 (0,3 mol); C3H8 (0,2 mol).
C. C2H6 (0,1 mol); C3H8 (0,4 mol).
D. C2H6 (0,4 mol); C3H8 (0,1 mol).
Hướng dẫn giải:
Đáp án D
nX = 0,5 mol; nY = 1 mol; MY = 8,2.2=16,4
Ta có:
Xem thêm các phương trình hóa học hay khác:
- C4H10 + Cl2 → C4H9Cl + HCl
- C4H10 + 2Cl2 → C4H8Cl2 + 2HCl
- C4H10 → C4H8 + H2
- C4H10 → C2H6 + C2H4
- 2C4H10 + 13O2 → 8CO2 + 10H2O
- C4H10 + Br2 → C4H9Br + HBr
- C4H10 + 2Br2 → C4H8Br2 + 2HBr
- CH3CH2CH2CH3 + O2 → 2CH3COOH + H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



