styrene + Br2 | C6H5CH=CH2 + Br2 → C6H5-CHBr-CH2Br
Phản ứng styrene + Br2 hay C6H5CH=CH2 + Br2 thuộc loại phản ứng trao cộng đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C6H5CH có lời giải, mời các bạn đón xem:
C6H5CH=CH2 + Br2 → C6H5-CHBr-CH2Br
1. Phương trình hoá học của phản ứng styrene tác dụng với Br2
C6H5 – CH = CH2 + Br2 → C6H5 – CHBr – CH2Br
2. Điều kiện của phản ứng styrene tác dụng với Br2
- Phản ứng diễn ra ở ngay điều kiện thường.
3. Hiện tượng của phản ứng styrene tác dụng với Br2
- Dung dịch brom nhạt màu dần đến mất màu.
4. Mở rộng kiến thức về styrene
4.1. Cấu tạo và tính chất vật lí
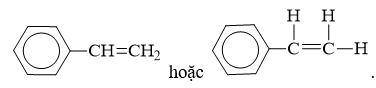
- Công thức phân tử: C8H8
- Công thức cấu tạo:
- styrene (còn gọi là vinylbenzen) là chất lỏng không màu, sôi ở 146oC, tan nhiều trong dung môi hữu cơ.
4.2. Tính chất hoá học
a) Phản ứng với dung dịch brom
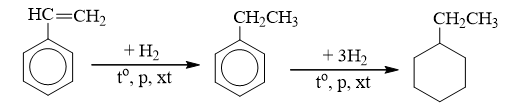
b) Phản ứng với hiđro
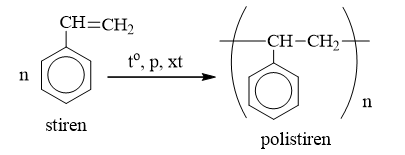
c) Phản ứng trùng hợp
5. Mở rộng kiến thức về brom
5.1. Tính chất vật lí và trạng thái tự nhiên
- Ở điều kiện thường, brom là chất lỏng, màu đỏ nâu, dễ bay hơi, hơi brom độc. Brom rơi vào da sẽ gây bỏng nặng.
- Brom tan trong nước, nhưng tan nhiều hơn trong các dung môi hữu cơ như ethanol, xăng …
- Trong tự nhiên brom tồn tại chủ yếu dưới dạng hợp chất, nhưng ít hơn nhiều so với hợp chất của clo và flo. Trong nước biển có chứa một lượng nhỏ muối NaBr.
5.2. Tính chất hóa học
Brom có tính oxi hóa kèm flo, clo tuy vậy brom vẫn là chất oxi hóa mạnh. Cụ thể:
- Brom oxi hóa được nhiều kim loại:
2Na + Br2 2NaBr
2Al + 3Br2 2AlBr3
- Brom chỉ oxi hóa được H2 ở nhiệt độ cao tạo ra khí hiđro bromua:
H2 + Br2 2HBr
Khí HBr tan vào nước tạo dung dich hydrobromic acid, đây là axit mạnh, mạnh hơn axit HCl.
- Brom tác dụng chậm với nước tạo ra hai axit: HBr (hydrobromic acid) và HBrO (axit hipobromơ):
Br2 + H2O HBr + HBrO
5.3. Ứng dụng
- Brom dùng để sản xuất một số dẫn xuất của hydrocarbon dùng trong công nghiệp dược phẩm.
- Một lượng lớn brom dùng chế tạo AgBr chất dùng để tráng lên phim ảnh.
- Hợp chất của brom dùng nhiều trong công nghiệp dầu mỏ, hóa chất cho nông nghiệp, phẩm nhuộm và các hóa chất trung gian.
5.4. Sản xuất brom trong công nghiệp
- Brom được sản xuất từ nước biển. Sau khi tách NaCl ra khỏi nước biển, dung dịch còn lại có hòa tan NaBr. Dùng khí clo để oxi hóa NaBr:
Cl2 + 2NaBr → 2NaCl + Br2
6. Bài tập vận dụng liên quan
Câu 1: Để phân biệt benzene, toluene, styrene ta chỉ dùng 1 thuốc thử duy nhất là:
A. Brom (dd).
B. Br2 (Fe).
C. KMnO4 (dd).
D. Br2 (dd) hoặc KMnO4(dd).
Hướng dẫn giải:
Đáp án C
Thuốc thử phù hợp là KMnO4 (dd):
- Mất màu ngay ở nhiệt độ thường → styrene
- Mất màu khi đun nóng → toluene
- Không mất màu ở bất kì điều kiện nào → benzene
Câu 2: A có công thức phân tử là C8H8, tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức. 1 mol A cộng tối đa với bao nhiêu mol H2 (Ni, to) và bao nhiêu mol Br2 trong dung dịch?
A. 4 mol H2; 1 mol brom.
B. 3 mol H2; 1 mol brom.
C. 3 mol H2; 3 mol brom.
D. 4 mol H2; 4 mol brom.
Hướng dẫn giải:
Đáp án A
C8H8 có k = = 5 tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức → có chứa 1 nối đôi ngoài vòng và 1 vòng benzene
→ Chỉ cộng tối đa 4 mol H2 (3π trong vòng + 1π ngoài vòng) và 1 mol Br2 trong dung dịch (chỉ cộng vào 1π ngoài vòng)
Câu 3:Đề hiđro hoá etylbenzen ta được styrene; trùng hợp styrene ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là:
A. 13,52 tấn.
B. 10,6 tấn.
C. 13,25 tấn.
D. 8,48 tấn.
Hướng dẫn giải:
Đáp án C
Sơ đồ phản ứng:
nC6H5-CH2-CH3 → nC6H5-CH=CH2 → PS
106n (gam)→104n (gam)
10,6 tấn←10,4 tấn
Do hiệu suất chỉ đạt 80% nên lượng etylbenzen thực tế cần dùng là:
= 13,25 tấn
Câu 4: Tiến hành trùng hợp 10,4 gam styrene được hỗn hợp X gồm polistiren và styrene (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp styrene là
A. 60%.
B. 75%.
C. 80%.
D. 83,33%.
Hướng dẫn giải:
Đáp án B
nstyrene ban đầu = = 0,1 mol
(1) C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
(2) Br2 + 2KI → 2KBr + I2
Theo (2): dư = = 0,005 mol → pư = 0,03 – 0,005 = 0,025 mol
Theo (1): nstyrene dư = pứ = 0,025 mol
→ nstyrene tham gia pứ trùng hợp = n ban đầu – n dư = 0,1 – 0,025 = 0,075 mol
Câu 5:Cho các phản ứng sau:
(1) 2Na + Br2 → 2NaBr.
(2) Br2 + 2NaOH → NaBrO + NaBr + H2O.
(3) Br2 + SO2 + H2O → 2HBr + H2SO4.
(4) Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl.
(5) Br2 + 2NaI → 2NaBr + I2.
(6) H2 + Br2 → 2HBr.
Số phản ứng mà brom (Br2) chỉ thể hiện tính oxi hoá là:
A. 0.
B. 3.
C. 4.
D. 6.
Hướng dẫn giải:
Đáp án C
Br2 thể hiện tính oxi hóa khi chỉ có sự giảm số oxi hóa từ 0 đến -1.
Các phản ứng thỏa mãn là: (1), (3), (5), (6)
(2) không thỏa mãn vì Br2 có số oxi hóa vừa tăng (từ 0 lên +1) và vừa giảm (0 xuống -1) → vừa có tính oxi hóa vừa có tính khử
(4) không thỏa mãn vì số oxi hóa của Br tăng từ 0 lên +5 → tính khử
Câu 6: Dẫn khí SO2 qua dung dịch Br2. Hiện tượng xảy ra là:
A. Dung dịch Br2 mất màu.
B. Xuất hiện kết tủa trắng.
C. Dung dịch Br2 mất màu và xuất hiện kết tủa trắng.
D. Dung dịch Br2 mất màu, xuất hiện kết tủa trắng và có khí màu vàng thoát ra.
Hướng dẫn giải:
Đáp án A
Dung dịch Br2 mất màu nhờ phản ứng:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Câu 7:Trong việc sản xuất brom từ các bromua có trong tự nhiên, để thu được 1 tấn brom phải cần dùng 0,6 tấn clo. Hiệu suất của quá trình điều chế brom là
A. 60%.
B. 73,96% .
C. 83,96%.
D. 90%.
Hướng dẫn giải:
Đáp án B
Cl2 + 2Br- → Br2 + 2Cl-
71 gam → 160 gam
x tấn →1 tấn
tấn
Thực tế lượng clo dùng là 0,6 tấn, vậy hiệu suất của quá trình điều chế là:
H =
Câu 8: Chất nào sau đây là chất lỏng ở điều kiện thường?
A. F2
B. Cl2.
C. Br2.
D. I2.
Hướng dẫn giải:
Đáp án C
Chất lỏng ở điều kiện thường là Br2
I2 là chất rắn
F2, Cl2 là chất khí.
Câu 9. styrene có công thức phân tử là:
A. C6H6
B. C7H8
C. C8H8
D. C8H10
Hướng dẫn giải:
Đáp án C
styrene: C6H5 – CH = CH2 hay công thức phân tử của styrene là C8H8.
Câu 10. Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
A. benzene
B. toluene
C. propan
D. styrene
Hướng dẫn giải:
Đáp án D
styrene làm mất màu dung dịch thuốc tím ngay điều kiện thường.
Xem thêm các phương trình hóa học hay khác:
- 3C6H5-CH=CH2 +10KMnO4 3C6H5COOK +3K2CO3 +10MnO2↓+KOH+4H2O
- C6H5-CH=CH2 + HBr → C6H5-CH(Br)-CH3
- C6H5CH3 + Br2 C6H5CH2Br + HBr
- C6H5CH3 + 2KMnO4 C6H5COOK + KOH + 2MnO2↓ + H2O
- C6H5 + Br2 C6H5Br + HBr
- C6H6 + HNO3 C6H5NO2 + H2O
- C6H5CH3 + HNO3 C6H2(NO2)3CH3 + 3H2O
- C6H6 + 3H2 C6H12
- C6H6 + 3Cl2 C6Cl6
- n-C6H5-CH=CH2 (CH2 -CH-C6H5)n
- 2C6H6 + 15O2 12CO2 + 6H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

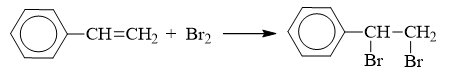







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



