C6H5NH2 + HCl → C6H5NH3Cl | aniline + HCl
Phản ứng aniline + HCl hay C6H5NH2 + HCl thuộc loại phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C6H5NH2 có lời giải, mời các bạn đón xem:
C6H5NH2 + HCl → C6H5NH3Cl
1. Phương trình phản ứng C6H5NH2 tác dụng với HCl
C6H5NH2 + HCl → C6H5NH3Cl
2. Điều kiện của phản ứng C6H5NH2 tác dụng với HCl
- Phản ứng diễn ra ngay điều kiện thường.
3. Hiện tượng của phản ứng C6H5NH2 tác dụng với HCl
- aniline tan dần, sau phản ứng thu được dung dịch đồng nhất.
4. Cách tiến hành phản ứng C6H5NH2 tác dụng với HCl
- Cho từ từ HCl vào ống nghiệm có chứa aniline C6H5NH2.
5. Mở rộng về tính chất hoá học của amin
a) Tính bazơ
- Các amin tan nhiều trong nước như methylamine, ethylamine … có khả năng làm xanh giấy quỳ tím hoặc hồng phenolphtalein, có lực bazơ mạnh hơn NH3 nhờ ảnh hưởng của nhóm ankyl.
- aniline có tính bazơ, nhưng dung dịch của nó không làm xanh giấy quỳ tím cũng không làm hồng phenolphtalein vì lực bazơ của nó yếu và yếu hơn NH3. Đó là do ảnh hưởng của gốc phenyl (tương tự phenol).
- Ta có thể so sánh lực bazơ như sau:
CH3 – NH2 > NH3 > C6H5 – NH2
v Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
CH3NH2 + HCl → CH3NH3Cl
v Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa
Ví dụ :
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
Ø Lưu ý : Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) ® hiđroxit kết tủa → kết tủa tan (tạo phức chất).
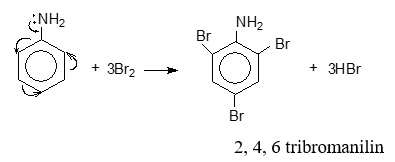
b) Phản ứng thế ở nhân thơm của aniline :
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của aniline bị thay thế bởi ba nguyên tử brom :
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromoaniline dùng nhận biết aniline
c) Phản ứng với nitrous acid HNO2 :
- Amin bậc một tác dụng với nitrous acid ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ:
C2H5NH2 + HONO → C2H5OH + N2 ↑ + H2O
- aniline và các amin thơm bậc một tác dụng với nitrous acid ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2 + HONO + HCl C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
d) Phản ứng cháy của amin no đơn chức mạch hở :
Ví dụ:
6. Bài tập vận dụng liên quan
Câu 1:Đốt cháy hoàn toàn m gam amin X (no, đơn chức, mạch hở) thu được CO2, H2O và 2,24 lít khí N2. Cho m gam X tác dụng hết với dung dịch HCl dư, số mol HCl đã phản ứng là
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Hướng dẫn giải:
Đáp án B
Câu 2:Ở điều kiện thường, amin X là chất lỏng, dễ bị oxi hoá khi để ngoài không khí. Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng. Amin nào sau đây thoả mãn tính chất của X?
A. dimethylamine
B. benzylamin
C. methylamine
D. aniline
Hướng dẫn giải:
Đáp án D
X là chất lỏng → A, C sai.
Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng → X là aniline
Câu 3: Cho 5,9 gam amin đơn chức X tác dụng vừa đủ với dung dịch HCl, tạo ra 9,55 gam muối, số công thức cấu tạo ứng với công thức phân tử của X là
A. 5.
B.4.
C. 3.
D.2.
Hướng dẫn giải:
Đáp án B
Gọi công thức của amin là RNH2
Phương trình:
Các công thức cấu tạo của X là
CH3CH2CH2-NH2
(CH3)2CH-NH2
CH3CH2-NH-CH3
(CH3)3N
Câu 4: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 1,344 lít khí CO2,
0,224 lít khí N2 (các thể tích khí đo ở đktc) và 1,62 gam H2O. Công thức của X là
A. C4H9N.
B. C3H7N.
C.C2H7N.
D. C3H9N.
Hướng dẫn giải:
Đáp án D
Amin đơn chức →
Số nguyên tử cacbon là: C =
Số nguyên tử hiđro là: H =
→ Công thức phân tử của amin X là C3H9N
Câu 5: Cho 10 gam hỗn hợp 2 amin no đơn chức, mạch hở tác dụng vừa đủ với V ml dung dịch HC1 1M, thu được dung dịch chứa 15,84 gam hỗn hợp muối. Giá trị của V là
A. 80.
B. 320.
C. 200.
D.160.
Hướng dẫn giải:
Đáp án D
Gọi công thức chung của hai amin đơn chức là RNH2
RNH2 + HCl → RNH3Cl
Bảo toàn khối lượng ta có:
lít = 160 ml
Câu 6: Một amin đơn chức bậc một có 23,73% nitơ về khối lượng, số đồng phân cấu tạo có thể có của amin này là
A. 2.
B. 3.
C. 4.
D.1.
Hướng dẫn giải:
Đáp án A
Gọi công thức của amin đơn chức bậc 1 có công thức dạng RNH2
→ Công thức phân tử của amin là C3H9N
Số đồng phân amin bậc I là:
CH3CH2CH2-NH2
(CH3)2CH-NH2
Câu 7: Dãy nào sau đây gồm các chất được xếp theo thứ tự tăng dần lực bazơ?
A. aniline, methylamine, amonia
B. aniline, amonia, methylamine
C. amonia, ethylamine, aniline
D. ethylamine, aniline, amonia
Hướng dẫn giải:
Đáp án B
Tính bazơ giảm dần: Amin no > NH3 > Amin thơm
→ Thứ tự tăng dần tính bazơ là: aniline, amonia, methylamine.
Câu 8: Dãy gồm tất cả các amin là
A. CH3NH2, CH3COOH, C2H5OH, C6H12O6.
B. C2H5OH, CH3NH2, C2H6O2, HCOOH.
C. C2H5NH2, (CH3)3N, CH3CHO, C6H12O6.
D. C2H5NH2, (CH3)3N, CH3NH2, C6H5NH2.
Hướng dẫn giải:
Đáp án D
Khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hydrocarbon ta được amin
→ Amin là những hợp chất chứa N
Câu 9: Thành phần phần trăm khối lượng nitơ trong phân từ aniline bằng
A. 18.67%.
B. 12,96%.
C. 15,05%.
D. 15,73%.
Hướng dẫn giải:
Đáp án C
Công thức phân tử của aniline là C6H7N
Câu 10: C6H5NH2 tên gọi là
A. Phenol.
B. methyl amin.
C. Benzyl amin.
D. aniline.
Hướng dẫn giải:
Đáp án D
C6H5NH2 có tên gọi là aniline.
Câu 11: Phát biểu nào sau đây đúng?
A. Tất cả các amin đều làm quỳ tím ẩm chuyển màu xanh.
B. Các amin đều không độc, được sử dụng trong chế biến thực phẩm.
C. Để rửa sạch ống nghiệm có dính aniline, có thể dùng dung dịch HCl.
D. Ở nhiệt độ thường, tất cả các amin đều tan nhiều trong nước.
Hướng dẫn giải:
Đáp án C
A sai vì aniline và các amin thơm không làm quỳ tím ẩm chuyển màu xanh.
B sai vì các amin rất độc.
C đúng vì aniline phản ứng được với HCl
C6H5NH2 + HCl → C6H5NH3Cl
D sai vì ở nhiệt độ thường, các amin như metyl-, dimethyl-, trimethyl- và ethylamine mới dễ tan trong nước.
Câu 12: Cho m gam một amin đơn chức ác dụng vừa đủ với 100ml dung dịch HCl 1M thu được 8,15 gam muối. Công thức phân tử của amin là
A. C2H7N.
B. C4H9N.
C. C2H5N.
D. C4H11N.
Hướng dẫn giải:
Đáp án A
Công thức của amin đơn chức là R-NH2
→ nmuối = 0,1 mol
→ R + 52,5 = → R = 29 (C2H5-)
→ Công thức của amin là C2H7N.
Xem thêm các phương trình hóa học hay khác:
- C6H5NH2 + HNO2 + HCl → C6H5N2Cl + 2H2O
- C6H5NH2 + 3Br2 → C6H3Br3NH2 + 3HBr
- C4H9NH2 + HCl → C4H9NH3Cl
- C4H9NH2 + HONO → C4H9OH + N2 + H2O
- C4H9NH2 + CH3I
C4H9NHCH3 + HI
- 3C4H9NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C4H9NH3Cl
- 4C4H11N + 27O2
16CO2 + 22H2O + 2N2
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



