100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 2)
Với 100 câu trắc nghiệm Nitơ, Photpho (cơ bản - phần 2) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nitơ, Photpho (cơ bản - phần 2).
100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 2)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài 1: Dẫn khí X đi qua ống sứ đựng CuO nung nóng, thu được hỗn hợp khí và hơi Y. Cho Y lần lượt qua ống (1) đựng CuSO4 khan dư và ống 2 đựng nước vôi trong. Thấy ống 1 chất rắn chuyển từ màu trắng sang màu xanh và ống 2 thấy nước vôi trong không bị vẩn đục. Vậy khí X là:
A. CH4 B. H2S C. NH3 D. HCl
Lời giải:
Hướng dẫn: Đáp án C
2NH3+ 3CuO→ N2+ 3Cu + 3H2O (1)
X là NH3, Y chứa N2, H2O, có thể NH3 dư
-Cho Y qua ống (1) đựng CuSO4 khan:
CuSO4 khan+ 5H2O → CuSO4.5H2O
Trắng xanh
-Cho Y quaống 2 đựng nước vôi trong: không có phản ứng nên nước vôi không bị vẩn đục
Đáp án A không đúng vì nếu X là CH4 thì Y chứa CO2, H2O
Khi cho Y qua nước vôi trong thì nước vôi trong bị vẩn đục do :
CO2+ Ca(OH)2 → CaCO3+ H2O
Đáp án B không đúng vì khí H2S không tác dụng với CuO
Đáp án D không đúng vì khí HCl không tác dụng với CuO
Bài 2: Tính lượng quặng photphoric chứa 90% canxi photphat dùng để điều chế 6,2 kg photpho nếu hiệu suất các phản ứng đều là 80%?
A. 43,056 g B. 43,056 kg C. 34,444 g D. 34,444 kg
Lời giải:
Hướng dẫn:Đáp án A
Ta có sơ đồ phản ứng:
Ca3(PO4)2 → 2P
Theo sơ đồ : nCa3(PO4)2= ½. nP= ½. 6200/31=100 mol
→mCa3(PO4)2= 100. 310= 310 00 gam= 31 kg
Do hiệu suất đạt 80% nên mCa3(PO4)2 thực tế= 31.100/80=38,75 gam
→ mquặng= 38,75.100/90=43,056 kg
Bài 3: Cho khí NH3 dư đi từ từ vào dung dịch X (chứa hỗn hợp CuCl2, FeCl3, AlCl3) thu được kết tủa Y. Nung kết tủa Y ta được chất rắn Z, rồi cho luồng khí NH3 dư đi từ từ qua Z nung nóng thu được chất rắn R. Trong R chứa:
A. Cu, Al, Fe B. Al2O3 và Fe 2O3 C. Fe D. Al2O3 và Fe
Lời giải:
Hướng dẫn: Đáp án D
3NH3+ AlCl3+ 3H2O→ 2Al(OH)3+3 NH4Cl (1)
3NH3+ FeCl3+ 3H2O→ 2Fe(OH)3+3 NH4Cl (2)
2NH3+ CuCl2+ 2H2O→ Cu(OH)2+2 NH4Cl (3)
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2 (4)
Do NH3 dư nên sau phản ứng chỉ thu được kết tủa Y gồm Al(OH)3 và Fe(OH)3
2Al(OH)3→Al2O3+ 3H2O (5)
2Fe(OH)3→Fe2O3+ 3H2O (6)
Chất rắn Z chứa Al2O3, Fe2O3
NH3 là chất khử chỉ khử được các oxit kim loại sau nhôm trong dãy hoạt động hóa học
2NH3+ Fe2O3→ N2+ 2Fe + 3H2O (1)
Vậy chất rắn R chứa Al2O3 và Fe
Bài 4: Cho 1,42 gam P2O5 tác dụng hoàn toàn với 50 ml dung dịch KOH 1M, thu được dung dịch X. Cô cạn dung dịch X thu được chất rắn khan gồm:
A. H3PO4 và KH2PO4 B. K3PO4 và KOH
C. KH2PO4 và K2HPO4 D. K2HPO4 và K3PO4
Lời giải:
Hướng dẫn: Đáp án D
Ta có P2O5+ 3H2O→2H3PO4
nH3PO4= 2.nP2O5=0,02 mol, nKOH=0,05 mol
Ta xét tỉ lệ T= nKOH/ nH3PO4= 0,05/0,02= 2,5
→ 2 ⟨T ⟨3
→Khi H3PO4 tác dụng với KOH xảy ra 2 phương trình sau :
H3PO4+ 2KOH→ K2HPO4+2 H2O
H3PO4+ 3KOH→ K3PO4+3 H2O
Cô cạn dung dịch X thu được K2HPO4 và K3PO4
Bài 5: Dẫn 1,344 lít khí NH3 vào bình chứa 0,672 lít khí Cl2 (đktc). Thành phần % thể tích của mỗi khí trong hỗn hợp khí sau phản ứng là:
A. 40%; 60% B. 20%, 80%
C. 30%, 70% D. 50%; 50%
Lời giải:
Hướng dẫn: Đáp án A
Ta có nNH3= 0,06 mol; nCl2= 0,03 mol
2NH3+3 Cl2 →N2+ 6HCl (1)
Ban đầu 0,06 0,03
Phản ứng 0,02 0,03 0,06 mol
Sau pứ 0,04 0,06 mol
Sau phản ứng thu được 0,04 mol NH3 và 0,06 mol HCl
→%VNH3= 40%; %VHCl= 60%
Bài 6: Cho dung dịch NH3 đến dư vào 20 ml dung dịch Al2(SO4)3. Để hòa tan hết kết tủa thu được sau phản ứng cần tối thiểu 10 ml dung dịch NaOH 2M. Nồng độ mol của dung dịch Al2(SO4)3 ban đầu là:
A. 0,6M B. 0,5M C. 0,4M D. 0,3M
Lời giải:
Hướng dẫn: Đáp án B 6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4 (1) NaOH + Al(OH)3 → NaAlO2+ H2O (2) Có nAl(OH)3= nNaOH= 0,01.2= 0,02 mol → nAl2(SO4)3= ½. nAl(OH)3= 0,01 mol → CM Al2(SO4)3= 0,01/ 0,02= 0,5M
Bài 7: Cho phản ứng tổng hợp ammoniac:
N2+ 3H2 ↔ 2 NH3
Khi giảm nồng độ NH3 (các yếu tố khác giữ nguyên) thì phản ứng sẽ chuyển dịch theo chiều nào?
A. thuận B. nghịch C. không thay đổi D. không xác định
Lời giải:
Hướng dẫn: Đáp án A
Theo nguyên lí chuyển dịch cân bằng khi giảm nồng độ NH3 thì cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó tức là chuyển dịch theo chiều thuận.
Bài 8: Trong 3 oxit: FeO, Fe2O3, Fe3O4 thì chất nào phản ứng với HNO3đặc nóng không tạo ra khí là:
A. Fe2O3 B. FeO và Fe3O3 C. Fe3O3 D. FeO
Lời giải:
Hướng dẫn: Đáp án A
Fe2O3+ 6 HNO3→ 2Fe(NO3)3+ 3H2O
FeO + 4HNO3 đặc nóng → Fe(NO3)3+ NO2↑+2 H2O
3Fe3O3 + 28HNO3đặc nóng → 9Fe(NO3)3+ NO2↑+ 14H2O
Bài 9: Cho V lít (đktc) hỗn hợp N2 và H2 có tỉ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H= 25%. Giá trị của V là:
A. 42 lít B. 268,8 lít C. 336 lít D. 448 lít
Lời giải:
Hướng dẫn: Đáp án B
N2+ 3H2⇄ 2NH3
Do hiệu suất tính theo N2
Đặt số mol N ban đầu là x mol, n3= 4x mol;
Do hiệu suất phản ứng là 25% nên nN2 pứ= 25%.x= 0,25x mol
N2+3H2⇄ 2NH3
Ban đầu x 4x mol
Phản ứng 0,25x 0,75x 0,5x mol
Sau pứ 0,75 x 3,25x 0,5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+3x)= 22,4.4.3=268,8 lít
Bài 10: Từ 10 m3 hỗn hợp N2 và H2 lấy theo tỉ lệ 1:3 về thể tích, biết hiệu suất phản ứng tổng hợp thực tế là 95%. Có thể sản xuất được lượng amonia là:
A. 5 m3 B. 4,25 m3 C. 4,75 m3 D. 7,5 m3
Lời giải:
Hướng dẫn: Đáp án C
Ở cùng điều kiện tỉ lệ về số mol bằng tỉ lệ thể tích
Đặt VN2=x m3, VH2= 3x m3 → Vhh= x+ 3x= 10 m3 → x= 2,5
→ VN2=2,5 m3, VH2= 7,5 m3
Ta có VN2/1= VH2/3 nên hiệu suất tính theo N2 hoặc H2
VN2 pứ= VN2.95%= 2,375 m3
N2+ 3H2 ⇄2NH3
2,375 → 4,75 m3
Bài 11: Phải dùng bao nhiêu lít khí nitơ để điều chế 17 gam NH3 biết hiệu suất phản ứng là 25%, các thể tích đo ở đktc.
A. 44,8 lít B. 22,4 lít C. 1,12 lít D. 4,48 lít
Lời giải:
Hướng dẫn: Đáp án A
N2+ 3H2⇄ 2NH3
nNH3= 1mol
Theo PTHH: nN2 (PT)= ½.nNH3= 0,5 mol; nH2 (PT)= 3/2. nNH3=1,5 mol
Công thức tính hiệu suất:
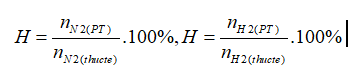
→nN2(thực tế)=2mol; nH2 (thực tế)= 6 mol
→VN2(thực tế)=44,8 lít;
Bài 12: Cho phản ứng: N2+ 3 H2 ↔ 2 NH3
Sau một thời gian, nồng độ các chất như sau: [N2]= 2,5 mol/l; [H2]= 1,5 mol/l; [NH3]= 2 mol/l. Nồng độ ban đầu của N2 và H2 lần lượt là:
A. 2,5M và 4,5 M B. 3,5 M và 2,5M
C. 1,5M và 3,5M D. 3,5M và 4,5M
Lời giải:
Hướng dẫn: Đáp án D
Nồng độ ban đầu của N2 và H2 lần lượt là: x, y mol/l
N2+ ⇄ 3H2 2NH3
Ban đầu x y mol/l
Phản ứng 1 3←2 mol/l
Sau pứ x-1 y-32 mol/l
Ta có: [N2]= 2,5 mol/l= x-1 nên x= 3,5M
[H2]= 1,5 mol/l= y-3 nên y=4,5M
Bài 13: Hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu:
A. giảm áp suất, tăng nhiệt độ B. giảm áp suất, giảm nhiệt độ
C. tăng áp suất, tăng nhiệt độ D. tăng áp suất, giảm nhiệt độ
Lời giải:
Hướng dẫn: Đáp án D
N2+ ⇄ 3H2 2NH3 ∆H ⟨0
Khi tăng áp suất cân bằng chuyển dịch theo chiều làm giảm số mol khí (tức là chiều thuận)
Phản ứng thuận có ∆H ⟨0 là phản ứng tỏa nhiệt
Nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thuận (tỏa nhiệt)
Vậy hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu: tăng áp suất và giảm nhiệt độ.
Bài 14: Tính số mol P2O5 cần thêm vào 0,3 lít dung dịch hỗn hợp KOH 1M và NaOH 1M để sau phản ứng thu được dung dịch chứa hai anion HPO42- và H2PO4- với số mol bằng nhau:
A. 0,1 B. 0,2 C. 0,3 D. 0,4
Lời giải:
Hướng dẫn: Đáp án B
P2O5+ 3H2O → 2 H3PO4 (1)
Tổng số mol OH- có trong dung dịch là 0,3.1+0,3.1= 0,6 mol
Đặt số mol HPO42- là x mol, số mol H2PO4- là x mol
OH-+ H3PO4 →H2PO4-+ H2O (2)
2OH-+ H3PO4 → HPO42-+ 2H2O (3)
Theo PT (2), (3) có nOH-= nH2PO4-+ 2nHPO4(2-)= x+ 2x= 3x (mol)= 0,6
Suy ra x= 0,2 mol→ nH3PO4 PT (2), (3)= x+ x= 0,4 mol
→nP2O5= ½. nH3PO4= 0,2 mol
Bài 15: Để làm khô khí amonia có thể dùng hóa chất nào dưới đây?
A. H2SO4 đặc B. P2O5 khan C. CaO khan D. CuSO4 khan
Lời giải:
Hướng dẫn: Đáp án C
Để làm khô khí amonia có thể dùng CaO khan vì CaO khan có khả năng hút ẩm nhưng không phản ứng với amonia: CaO + H2O → Ca(OH)2
Không lựa chọn H2SO4 đặc vì: 2NH3+ H2SO4→ (NH4)2SO4
Không lựa chọn P2O5 vì: P2O5+ 3H2O → 2 H3PO4
Sau đó H3PO4 phản ứng với NH3 theo PT: 3NH3+ H3PO4→ (NH4)3PO4
Không lựa chọn CuSO4 khan vì:
2NH3+ CuSO4+ 2H2O→ Cu(OH)2+(NH4)2SO4
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2
Chất được chọn để làm khô phải có khả năng hút nước và không phản ứng với chất cần làm khô.
Bài 16: Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
A. 4 lít B. 6 lít C. 8 lít D. 12 lít
Lời giải:
Hướng dẫn: Đáp án D
N2+ 3H2⇄ 2NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
Bài 17: Thể tích hỗn hợp N2 và H2 (đktc) cần lấy để điều chế 102 gam NH3 (H=25%) là:
A. 1075 lít B. 538 lít C. 1075,2 lít D. 537,6 lít
Lời giải:
Hướng dẫn: Đáp án C
N2+ 3H2⇄ 2NH3
Ta có nNH3=6mol
Theo PT : nN2= ½. nNH3= 3 mol, nH2= 3/2nNH3=9 mol
Do hiệu suất bằng 25% nên nN2 thực tế= nN2.100/25=12 mol
Ta có nH2 thực tế= nH2.100/25= 9.4= 36 mol
→Tổng nhỗn hợp= 12+ 36= 48 mol→ Vhỗn hợp= 48.22,4=1075,2 lít
Bài 18: Để điều chế 2 lít khí NH3 từ N2 và H2 với hiệu suất 25% thì cần bao nhiêu lít khí N2 ở cùng điều kiện?
A. 8 lít B. 2 lít C. 4 lít D. 1 lít
Lời giải:
Hướng dẫn:
N2+ 3H2⇄ 2NH3
Trong cùng điều kiện thì tỉ lệ thể tích bằng tỉ lệ số mol
Theo PT : VN2= ½. VNH3= 1 lít, VH2= 3/2. VNH3=3 lít
Do hiệu suất 25% nên VN2 thực tế= VN2.100/25= 4 lít
Bài 19: Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng:
A. 20%; 60%; 20% B. 22,22%; 66,67%; 11,11%
C. 30%; 60%; 10% D. 33,33%; 50%; 16,67%
Lời giải:
Hướng dẫn: Đáp án B
Chọn thể tích ban đầu của N2 là 1 lít, H2 là 3 lít → Thể tích ban đầu là 4 lít
→Thể tích khí giảm là Vkhí giảm= 1/10.Vban đầu= 1/10.4= 0,4 lít
→VNH3 sinh ra= Vban đầu- Vsau= Vkhí giảm= 0,4 lít
N2+ 3H2⇄ 2NH3
VN2 pứ= 1/2VNH3 sỉnh = 0,2 lít, VH2 pứ= 3/2.VNH3sinh= 0,6 lít
→VN2 dư= 0,8 lít, VH2 dư= 3-0,6= 2,4 lít
Tổng thể tích khí sau phản ứng là Vsau=9/10.Vban đầu= 0,9.4= 3,6 lít
→%VN2 dư= 0,8.100%/3,6=22,22%; %VH2 dư= 2,4.100%/3,6=66,67%
%VNH3=11,11%
Bài 20: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là:
A. Có kết tủa trắng
B. Không có hiện tượng
C. Có khí mùi khai bay lên và có kết tủa trắng
D. Có khí mùi khai bay lên
Lời giải:
Hướng dẫn: Đáp án C
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
Bài 21: Có 4 dung dịch trong 4 lọ mất nhãn: amoni sunfat, ammonium chloride, sodium sulfate, sodium hydroxide. Nếu chỉ được phép dùng một thuốc thử để nhận biết 4 chất lỏng trên ta có thể dùng thuốc thử nào sau đây?
A. dung dịch AgNO3 B. dung dịch KOH
C. dung dịch BaCl2 D. dung dịch Ba(OH)2
Lời giải:
Hướng dẫn: Đáp án D
Khi cho dung dịch Ba(OH)2 vào 4 dung dịch:
-Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
-Nếu xuất hiện kết tủa trắng thì đó là Na2SO4
Na2SO4+ Ba(OH)2→ BaSO4↓ + 2 NaOH
-Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
-Còn lại không hiện tượng là NaOH
Bài 22: Đun nóng hỗn hợp rắn gồm 2 muối (NH4)2CO3 và NH4HCO3 thu được 13,44 lít khí NH3 và 11,2 lít khí CO2 (đktc). Thành phần % của NH4HCO3 là:
A. 23,3% B. 76,7% C. 75% D. 25%
Lời giải:
Hướng dẫn: Đáp án B
Đặt n(NH4)2CO3= xmol; nNH4HCO3= y mol
(NH4)2CO3→ 2NH3+ CO2+ 2H2O
x 2x x mol
NH4HCO3 →NH3+ CO2+ H2O
y y y mol
Ta có nNH3= 2x+y= 13,44/22,4= 0,6
nCO2= x+y= 11,2/22,4= 0,5
Suy ra x=0,1, y=0,4→ mchất rắn= 0,1.96+ 0,4.79=41,2 gam
→% của NH4HCO3 là: 0,4.79.100%/41,2=76,7%
Bài 23: Hòa tan hỗn hợp gồm 8,49 gam P và S vào lượng HNO3 vừa đủ thu được dung dịch X và sản phẩm khử duy nhất là NO2. Để trung hòa hoàn toàn X thì cần vừa đủ 0,69 mol NaOH. Số mol NO2 thu được là:
A. 1,47 mol B. 1,5 mol C. 1,28 mol D. 1,35 mol
Lời giải:
Hướng dẫn: Đáp án A
Đặt số mol P và S lần lượt là x, y mol → 31x+ 32y= 8,49 (1)
P+ 5HNO3→ H3PO4+ 5NO2+ H2O (1)
S+ 6HNO3→ H2SO4+ 6NO2+ 2H2O (2)
Dung dịch X chứa H3PO4 và H2SO4
H3PO4+ 3NaOH→ Na3PO4+ 3H2O(3)
H2SO4+ 2NaOH→ Na2SO4+ 2H2O (4)
Theeo PT (1) , (2), (3), (4)
Tổng số mol NaOH pứ ở (3), (4) là:
nNaOH= 3nH3PO4+ 2nH2SO4= 3.nP+ 2.nS= 3x+2y=0,69 (2)
Giải hệ gồm (1) và (2) có x=0,15; y= 0,12
Theo PTHH (1) và (2) : nNO2= 5nP+ 6nS= 5x+ 6y= 1,47 mol
Bài 24: Có 4 lọ chứa 4 dung dịch riêng biệt sau: 1. NH3; 2. FeSO4; 3. BaCl2; 4. HNO3. Các cặp dung dịch nào có thể phản ứng nhau:
A. 1 và 4; 2 và 3;2 và 4; 1 và 2
B. 1 và 3; 2 và 3; 3 và 4;1 và 2
C. 1 và 4;2 và 3; 3 và 4;1 và 2
D. 1 và 3; 1 và 4; 2 và 4; 1 và 2
Lời giải:
Hướng dẫn: Đáp án A
Các phương trình hóa học xảy ra là:
1 và 4 xảy ra PT: NH3+ HNO3→ NH4NO3
2 và 3xảy ra PT: FeSO4+ BaCl2 → BaSO4+ FeCl2
2 và 4xảy ra PT: 3Fe2++ 4H++ NO3-→ 3Fe3++ NO + 2H2O
1 và 2xảy ra PT: 2NH3+ FeSO4+ 2H2O→ Fe(OH)2+ (NH4)2SO4
Bài 25: Có 6 dung dịch đựng trong 6 lọ: NH4Cl; (NH4)2SO4; MgCl2; AlCl3; FeCl2; FeCl3. Chỉ dùng một hóa chất nào sau đây có thể giúp nhận biết chất nào trên?
A. Na dư B. dung dịch NaOH dư C. Ba dư D. dung dịch AgNO3
Lời giải:
Hướng dẫn: Đáp án C
Khi cho Ba vào các dung dịch trên thì Ba+ H2O →Ba(OH)2+ H2
Lấy dung dịch Ba(OH)2thu được ở trên cho vào 6 dung dịch:
-Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
-Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
-Nếu xuất hiện kết tủa trắng, không tan trong kiềm dư thì đó là MgCl2
Ba(OH)2+ MgCl2 → Mg(OH)2↓ + BaCl2
-Nếu xuất hiện kết tủa trắng, tan trong kiềm dư thì đó là AlCl3
3Ba(OH)2+ 2AlCl3 → 2Al(OH)3↓ + 3BaCl2
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O
-Nếu xuất hiện kết tủa trắng xanh, không tan trong kiềm dư thì đó là FeCl2
Ba(OH)2+ FeCl2 → Fe(OH)2↓ + BaCl2
-Nếu xuất hiện kết tủa nâu đỏ, không tan trong kiềm dư thì đó là FeCl3
3Ba(OH)2+ 2FeCl3 → 2Fe(OH)3↓ + 3BaCl2
Bài 26: Cho 1,32 gam (NH4)2SO4 tác dụng với lượng dư dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ toàn bộ lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
A. (NH4)3PO4 B. NH4H2PO4
C. (NH4)2HPO4 D. NH4H2PO4 và (NH4)2HPO4
Lời giải:
Hướng dẫn: Đáp án C
(NH4)2SO4+ 2NaOH→ Na2SO4 + 2NH3↑ + 2H2O (1)
Theo PT (1): nNH3= 2. n(NH4)2SO4= 2.0,01=0,02 mol
Có: nH3PO4=0,04mol → T= nNH3/nH3PO4= 2 → Xảy ra PT sau:
2NH3+ H3PO4→ (NH4)2HPO4
Bài 27: Cho 6,16 lít khí NH3 và V ml dung dịch H3PO4 0,1M phản ứng hết với nhau được dung dịch X. X phản ứng được tối đa 300 ml dung dịch NaOH 1M. Khối lượng muối khan có trong X bằng:
A. 147,0 g B. 13,235 g C. 14,475 g D. 14,9 g
Lời giải:
Hướng dẫn:
n(NH3) = 6,16/22,4 = 0,275mol
n(NaOH) = 1.0,3 = 0,3mol
Dung dịch X phản ứng tối đa với NaOH nên muối thu được là muối Na3PO4
Theo ĐL bảo toàn nguyên tố:
n(H3PO4) = n(Na3PO4) = n(NaOH)/3 = 0,3/3 = 0,1mol
n(NH3)/n(H3PO4) = 0,275/0,1 = 2,75
2 ⟨ n(NH3)/n(H3PO4)⟨ 3 → cả 2 chất đều tham gia pư hết
Theo ĐL bảo toàn khối lượng, khối lượng muối thu được là:
m(muối) = m(NH3) + m(H3PO4) = 17.0,275 + 98.0,1 = 14,475g
Bài 28: Có những nhận định sau về muối amoni:
1)Tất cả muối amoni đều tan trong nước
2)Các muối amoni đều là chất điện li mạnh, trong nước muối amoni điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường bazơ
3)Muối amoni đều phản ứng với dung dịch kiềm giải phóng khí amonia
4)Muối amoni kém bền đối với nhiệt
Nhóm gồm các nhận định đúng là:
A. 1, 2, 3 B. 1, 3,4 C. 2, 3,4 D. 1, 2, 4
Lời giải:
Hướng dẫn: Đáp án B
1)Đúng
2)Sai vì NH4+ tạo môi trường axit
3)Đúng
4)Đúng
Bài 29: Dãy các muối amoni nào khi bị nhiệt phân tạo thành khí NH3?
A. NH4Cl, NH4HCO3, (NH4)2CO3
B. NH4Cl, NH4NO3, NH4HCO3
C. NH4Cl, NH4NO3, NH4NO2
D. NH4NO3, NH4HCO3, (NH4)2CO3
Lời giải:
Hướng dẫn: Đáp án A
Đáp án A:
(NH4)2CO3→ 2NH3+ CO2+ 2H2O
NH4HCO3 →NH3+ CO2+ H2O
NH4Cl→ NH3+ HCl
Còn ở đáp án B: NH4NO3→N2O+ 2H2O (không tạo khí NH3)
Ở đáp án C: NH4NO2→N2+ 2H2O (không tạo khí NH3)
Ở đáp án D: NH4NO3→N2O+ 2H2O (không tạo khí NH3)
Bài 30:Cho sơ đồ phản ứng sau:
Khí X dung dịch X Y X Z T
Công thức của X, Y, Z, T tương ứng là:
A. NH3, (NH4)2SO4, N2, NH4NO3
B. NH3, (NH4)2SO4, N2, NH4NO2
C. NH3, (NH4)2SO4, NH4NO3, N2O
D. NH3, N2, NH4NO3, N2O
Lời giải:
Hướng dẫn: Đáp án C
Khí NH3+ H2O → dung dịch NH3
2NH3+ H2SO4→(NH4)2SO4 (Y)
(NH4)2SO4+ 2NaOH→ Na2SO4+ 2NH3 (X)+ H2O
NH3+ HNO3→ NH4NO3 (Z)
NH4NO3→N2O (T)+ 2H2O
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 1)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 3)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 1)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 2)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 3)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 4)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

