150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 3)
Với 150 câu trắc nghiệm Nitơ, Photpho (nâng cao - phần 3) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nitơ, Photpho (nâng cao - phần 3).
150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 3)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài 1: Cho 0,87 gam hỗn hợp gồm Fe, Cu và Al vào bình đựng 300 ml dung dịch H2SO4 0,1M. Sau khi các phản ứng xảy ra hoàn toàn thu được 0,32 gam chất rắn và có 448 ml khí (đktc) thoát ra. Thêm tiếp vào bình 0,425 gam NaNO3, khi các phản ứng kết thúc thì thể tích khí NO (đktc, sản phẩm khử duy nhất) tạo thành và khối lượng muối trong dung dịch là:
A.0,224 lít và 3,750 gam B. 0,112 lít và 3,750 gam
C. 0,224 lít và 3,865 gam D. 0,112 lít và 3,865 gam
Lời giải:
Hướng dẫn:
Cho 0,87 gam hỗn hợp gồm Fe, Cu và Al vào dung dịch H2SO4
→ Chất rắn không tan là Cu, mCu= 0,32 gam, nCu=0,005 mol
2Al+ 3H2SO4 → Al2(SO4)3+ 3H2
Fe+ H2SO4 → FeSO4+ H2
Ta có mFe + mAl = 0,87 - 0,32 = 0,55 gam
Đặt nFe= x mol, nAl= y mol → 56x + 27y= 0,55
nH2= 1,5.x+ y= 0,448/22,4= 0,02 mol
→ x = 0,005; y= 0,01
ta có nH2SO4 ban đầu= 0,3.0,1=0,03 mol, nH2= 0,448/22,4=0,02 mol
nH+ còn lại = nH+ ban đầu- nH+ pứ= 2.nH2SO4- 2.nH2= 2. 0,03- 2.0,02= 0,02 mol
nNO3- =nNaNO3= 0,005 mol
Ta có các bán phản ứng sau
Fe2+ → Fe3+ + 1e
0,005 0,005
Cu -→ Cu2+ + 2e
0,005 0,01
=> ne cho = 0,015 mol= ne nhận
4H+ + NO3- + 3e → NO + 2H2O (3)
0,02 0,005 0,015 0,005
V = 0,005.22,4 = 0,112 lít
Theo bán phản ứng (3) thì cả H+ và NO3- đều hết
Khối lượng muối=Khối lượng kim loại + mNa+ + mSO4
= 0,87 + 0,005.23 + 0,03.96 = 3,865 gam
Đáp án D
Bài 2: Hòa tan hết một lượng S và 0,01 mol Cu2S trong dung dịch HNO3 đặc, nóng, sau phản ứng hoàn toàn dung dịch thu được chỉ có 1 chất tan và sản phẩm khử là khí NO2 duy nhất. Hấp thụ hết lượng NO2 này vào 200 ml dung dịch NaOH 1M, rồi cô cạn dung dịch sau phản ứng thì được m gam chất rắn khan. Giá trị của m là
A. 18,4. B. 12,64.
C. 13,92. D. 15,2.
Lời giải:
Hướng dẫn:
Dễ dàng thấy chất tan là CuSO4 = 0,02 mol (bảo toàn nguyên tố Cu)
=> Quy đổi ban đầu có 0,02 mol S (bảo toàn nguyên tố S) và 0,02 mol Cu
Bảo toàn e => n NO2 = 0,02.6 + 0,02.2 = 0,16 mol
QT cho e :
Cu → Cu2++ 2e
0,02 0,04 mol
S0 → SO42-+ 6e
0,02 0,12 mol
Số mol e cho là ne cho= 0,16 mol
Theo bảo toàn e : ne cho= ne nhận= 0,16 mol
QT nhận e :
N+5+ 1e → NO2
0,16 → 0,16 mol
2NaOH + 2NO2 => NaNO2 + NaNO3 + H2O
Do 0,2> 0,16 nên NO2 hết và NaOH dư
Vì NO2 hết nên n H2O = 0,08 mol (= ½ n NO2)
→ m chất rắn = mNO2+ mNaOH- mH2O= 40.0,2 + 0,16.46 – 0,08.18 = 13,92 gam
Đáp án C
Bài 3: Thực hiện 2 thí nghiệm:
TN 1: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1,0M thoát ra a lít NO.
TN2: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1,0M và H2SO4 0,5 M thoát b lít NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Quan hệ giữa a và b là
A. b = a. B. b = 2a. C. 2b = 5a. D. 2b = 3a.
Lời giải:
Hướngdẫn:
(*) TN1 :
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
0,06 0,08 → 0,02 mol
(*) TN2 :
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,06 0,16 0,08 → 0,04 mol
→ b= 2a
Đáp án B
Bài 4: Cho m gam hỗn hợp Cu, Fe, Al tác dụng hoàn toàn với dung dịch HNO3 loãng dư thu được (m+31) gam muối nitrate. Nếu cũng cho m gam hỗn hợp trên tác dụng với oxi thu được các oxit CuO, Fe2O3, Al2O3 thì khối lượng oxit là:
A.m + 32 B. m+16 C. m+4 D. m+48
Lời giải:
Hướng dẫn:
Ta có: mNO3-= mmuối nitrate- mkim loại= (m+31)-m= 31 gam → nNO3-= 0,5 mol
Ta thấy số oxi hóa của Cu, Fe, Al trong muối nitrate và trong các oxit tương ứng là bằng nhau
→nNO3-= nđiện tích dương của cation= 2.nO2- → nO2-= 0,25 mol
→ moxit= mkim loại+ mO2-= m+ 0,25.16= m+ 4 (gam)
Đáp án C
Bài 5: X là hỗn hợp các muối Cu(NO3)2, Fe(NO3)2, Fe(NO3)3, Mg(NO3)2 trong đó O chiếm 55,68% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 50 gam muối, lọc kết tủa thu được đem nung trong chân không đến khối lượng không đổi thu được m gam oxit. Giá trị của m là
A. 31,44. B. 18,68. C. 23,32. D. 12,88.
Lời giải:
Hướng dẫn:
Khối lượng O có trong 50 gam hỗn hợp muối A là:
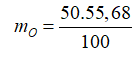
Bảo toàn nguyên tố O ta có: nNO3- (muối)= 1/3.nO= 0,58 mol
→ mkim loại= mA- mNO3-= 50- 0,58.62=14,04 gam
Bảo toàn điện tích ta có: nNO3-= nđiện tích dương kim loại= 2.nO2- trong oxit
→ nO2- trong oxit= 0,58/2= 0,29 mol
→moxit= mkim loại+ mO2- trong oxit= 14,04 + 0,29.16=18,68 gam
Đáp án B
Bài 6: A là hỗn hợp muối Cu(NO3)2, Fe(NO3)3, Fe(NO3)2, Al(NO3)3. Trong đó N chiếm 16,03% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 65,5 gam muối. Lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được bao nhiêu gam oxit?
A. 27 B. 34 C. 25 D. 31
Lời giải:
Hướngdẫn:
Khối lượng N có trong 65,5 gam hỗn hợp muối A là:
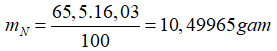
Bảo toàn nguyên tố N ta có: nNO3- (muối)= nN= 0,75 mol
→ mkim loại= mA- mNO3-= 65,5- 0,75.62=19 gam
Bảo toàn điện tích ta có: nNO3-= nđiện tích dương kim loại= 2.nO2- trong oxit
→ nO2- trong oxit= 0,75/2= 0,375 mol
→moxit= mkim loại+ mO2- trong oxit= 19 + 0,375.16=25 gam
Đáp án C
Bài 7: Hòa tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa hai muối sunfat) và khí duy nhất NO. Giá trị của a là:
A. 0,04 B. 0,075 C. 0,12 D. 0,06
Lời giải:
Hướng dẫn:
Ta có sơ đồ phản ứng :
FeS2, Cu2S+ HNO3 →Fe2(SO4)3+ CuSO4+ NO+ H2O
Bảo toàn nguyên tố Fe ta có: nFe2(SO4)3= 1/2. nFeS2= 0,12/2= 0,06 mol
Bảo toàn nguyên tố Cu ta có: nCuSO4= 2.nCu2S= 2 a mol
Bảo toàn nguyên tố S có nS( FeS2, Cu2S)= nS (trong 2 muối sunfat)
Nên 2.0,12+ a= 3.0,06+ 2a→ a= 0,06 mol
Đáp án D
Bài 8: Cho 10,62 gam hỗn hợp gồm Fe, Zn vào 800 ml dung dịch hỗn hợp X gồm NaNO3 0,45 M và H2SO4 0,9M. Đun nóng cho phản ứng xảy ra hoàn toàn thu được dung dịch Y và 3,584 lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Tính % khối lượng Fe trong hỗn hợp ban đầu.
A. 63,28% B. 36,72% C. 58,26% D. 41,74%
Lời giải:
Hướng dẫn:
Số mol NaNO3 = 0,36 mol
số mol H2SO4 = 0,72 mol → số mol H+ = 1,44 mol
Ta có các bán phản ứng:
NO3- + 4H+ + 3e → NO + 2H2O (1)
mol 0,16 ← 4.0,16 0,16.3 ← 0,16
Số mol NO = 0,16 mol => H+ và NO3- dư, kim loại phản ứng hết.
Số mol NO3- phản ứng = 0,16 mol; số mol H+ phản ứng = 0,64 mol
Fe → Fe3+ + 3e(1)
Zn → Zn2+ + 2e(2)
Gọi số mol Fe là x mol, số mol Zn là y mol
Theo khối lượng hỗn hợp ban đầu ta có phương trình
56 x + 65 y = 10,62 (I)
Theo định luật bảo toàn electron ta có phương trình
3x + 2y = 0,16.3 (II)
Giải hệ phương trình (I), (II) ta có: x = 0,12 và y = 0,06 mol
mFe = 0,12.56 = 6,72 g => % mFe = 63,28%
Bài 9: Khi cho cùng một lượng kim loại M vào dung dịch HNO3 đặc nóng dư và dung dịch H2SO4 loãng dư, phản ứng hoàn toàn thì thể tích khí NO2 (sản phẩm khử duy nhất) thu được gấp 3 lần thể tích khí H2 ở cùng điều kiện nhiệt độ và áp suất. Khối lượng muối sunfat thu được bằng 62,81% khối lượng muối nitrate tạo thành. Xác định kim loại M?
A. Zn B. Fe C. Mg D. Ca
Lời giải:
Hướngdẫn:
Gọi n, m là hóa trị của R khi tác dụng HNO3 và H2SO4 loãng ( 1≤ m≤ n≤ 3)
Chọn nR= 1 mol
2R + mH2SO4 →R2(SO4)m + mH2↑
1 → 0,5 0,5m
R + 2nHNO3 →R(NO3)n + nNO2 + nH2O
1 1 n
Ta có: n=3.0,5m → n=1,5m → m=2, n=3 là phù hợp.
Ta có: (R + 96)=(R + 186). 0,6281 → R=56 R là Fe.
Đáp án B
Bài 10: Cho 4,48 lít khí NH3 (đktc) qua lượng dư CuO nung nóng, sau một thời gian phản ứng thu được hỗn hợp khí và hơi Y có tỉ khối so với H2 bằng 9,5. Hiệu suất của phản ứng trên là:
A. 30% B. 40% C. 50% D. 60%
Lời giải:
Hướng dẫn:
Ta có: n NH3= 0,2 mol
2NH3+ 3CuO → N2+ 3Cu+ 3H 2O
nPỨ 2x x 3x mol
Hỗn hợp khí và hơi Y thu được có :
x mol N2, 3x mol H2O, 0,2-2x mol NH3 dư
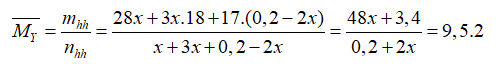
→x= 0,04 mol
→
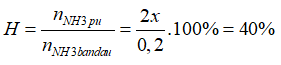
Đáp án B
Bài 11: Cho 7,68 gam Cu vào 200 ml dung dịch gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là:
A. 19,76 gam B. 20,16 gam
C. 19,20 gam D. 22,56 gam
Lời giải:
Hướngdẫn:
nCu= 0,12 mol; nHNO3= 0,12 mol; nH2SO4= 0,1 mol
3Cuhết + 8H+hết + 2NO3-dư→ 3Cu2+ + 2NO + 4H2O
0,12 0,32 0,12 → 0,12
nNO3- dư= 0,12- 0,12.2/3= 0,04 mol
Muối khan thu được có chứa: 0,12 mol Cu2+, 0,04 mol NO3- và 0,1 mol SO42-
→ mmuối khan= 0,12.64+ 0,04.62+ 0,1.96= 19,76 gam
Bài 12: Cho Zn tới dư vào dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với:
A. 64 gam B. 65 gam C. 70 gam D. 75 gam
Lời giải:
Hướngdẫn:
MY= 24,4 → Y chứa H2. Khí không màu hóa nâu ngoài không khí là NO → Y chứa NO và H2.
Gọi x và y lần lượt là số mol của H2 và NO
Ta có: x+ y= 0,125; 2x+ 30y= 0,125.24,4 → x= 0,025; y= 0,1
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua
Do nNO3(-)ban đầu= 0,15 mol > nNO= 0,1 mol→ X chứa NH4+
Theo bảo toàn nguyên tố N → nNH4+= 0,15-0,1= 0,05 mol
Theo bảo toàn electron: 2.nZn pứ= 3.nNO+ 8nNH4++ 2nH2= 0,75 mol→ nZn pứ= nZn2+= 0,375 mol
→mmuối= mZnCl2+ mNH4Cl+ mNaCl+ mKCl= 136. 0,375+ 53,5.0,05+ 58,5.0,05+ 74,5.0,1= 64,05 gam
Đáp án A
Bài 13: Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỉ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740 ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa. Nồng độ phần trăm của Zn(NO3)2 trong dung dịch X là:
A. 28,02% B. 14,29%
C. 14,32% D. 12,37%
Lời giải:
Hướng dẫn:
Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN(Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron→ số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Bài 14: Cho 39,84 gam hỗn hợp X1 gồm Fe3O4 và Cu vào dung dịch HNO3 đun nóng, thu được 0,2/3 mol NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y1 và 3,84 gam Cu. Cho từ từ đến dư dung dịch NH3 vào dung dịch Y1, không có không khí, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
A. 27 gam B. 46,6 gam C. 40,5 gam D. 42,5 gam
Lời giải:
Hướng dẫn:
Gọi nFe3O4 =x mol; nCu (phản ứng) = y mol
3Fe 3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O (1)
3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2 (3)
Fe(NO3)2 + 2NH3 + 2H2O→ Fe(OH)2 + 2NH4NO3 (4)
Cu(NO3)2 + 2NH3 + 2H2O → Cu(OH)2 + 2NH4NO3 (5)
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (6)
Ta có hệ: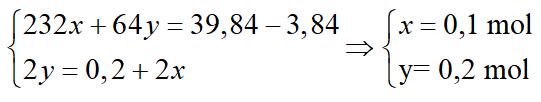
Đáp án A
Bài 15: Để 26,88 gam phôi Fe ngoài không khí một thời gian, thu được hỗn hợp rắn X gồm Fe và các oxit. Hòa tan hết X trong 288 gam dung dịch HNO3 31,5%, thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn Y, rồi nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Xác định nồng độ % Fe(NO3)3 trong Y?
A. 28,14% B. 26,36% C. 24,47% D. 25,19%
Lời giải:
Hướngdẫn:
2Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2
a mol → 2a 0,25a
2Fe(NO3)3 → Fe2O3 +6NO2 + 3/2O2
b mol → 3b 0,75b
Ta có hệ:
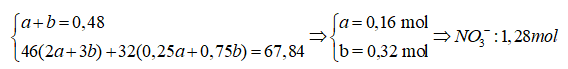
nN(trong Z)=1,44-1,28=0,16 mol→ mZ=(0,16.14.100)/(100-61,11)=5,76 gam
Sơ đồ: X + HNO3 → Muối + Z + H2O
→ mX + 1,44.63 = 0,16.180 + 0,32.242 + 0,74.18
→ mX = 34,24 gam → m(dung dịch sau)=34,24+288 – 5,76=316,48 gam
Vậy: C%(Fe(NO3)3) = (0,32.242.100)/316,48 = 24,47%
Đáp án C
Bài 16: Cho hỗn hợp X gồm FeCO3, FeS2 tác dụng vừa đủ với dung dịch HNO3 đặc, nóng thu được dung dịch Y (chứa Fe(NO3)3; H2SO4) và 22,4 lít hỗn hợp khí Z gồm hai khí (đktc). Pha loãng dung dịch Y bằng nước cất để thu được 2 lít dung dịch có pH = 1. (Biết sản phẩm khử của N+5 là NO2). Khối lượng hỗn hợp X là:
A. 20,5 gam B. 22,5 gam C. 21,5 gam D. 23,5 gam
Lời giải:
Hướng dẫn:
FeCO3 + 4HNO3→ Fe(NO3)3 + CO2 + NO2 + 2H2O (1)
0,125 0,125 0,125 0,125
FeS2 + 18HNO3 →Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O (2)
0,05 0,05 0,1 0,75
Vì pH = 1→ [H+] = 0,1→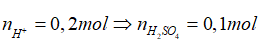
Theo (2) có: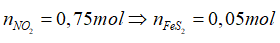
Gọi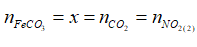
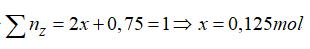
→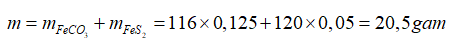
Đáp án A
Bài 17: Hòa tan hết 1 gam kim loại X trong lượng dư dung dịch HNO3 15%, thu được 446 ml (đktc) hỗn hợp Y gồm ba khí. Trong Y có chứa 117 mg N2 và 269 mg NO. Biết trong Y thì nguyên tố N chiếm 60,7% về khối lượng. Xác định kim loại X?
A. Zn B. Ca C. Ba D. Mg
Lời giải:
Hướng dẫn:
Gọi khí thứ 3 là NxOy, theo giả thiết ta có số mol các khí là
N2 = 4,1786.10-3 mol; NO = 8,967.10-3 mol; NxOy = 6,765.10-3 mol.
Suy ra %N =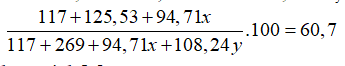
→8,2 +94,71x = 4,1.MNxOy
Xét các giá trị của x = 1, 2, 3 không có oxit nào của nitơ thõa mãn
→ x= 0 và M = 2, khí thứ 3 là H2
Dùng bảo toàn e → X = 12.n. Vậy n = 2 và X = 24, kim loại là Mg
PTHH: 9Mg + 22HNO3 → 9 Mg(NO3)2 + N2 + 2NO + H2 + 10H2O
Đáp án D
Bài 18: Cho 11,2 gam Fe vào 300 ml dung dịch chứa (HNO3 0,5M và HCl 2M) thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Biết các phản ứng xảy ra hoàn toàn. Cô cạn dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 27,775 gam B. 27,175 gam
C. 28,125 gam D. 28,325 gam
Lời giải:
Hướng dẫn:
nFe = 0,2 mol;
nHNO3 = 0,15; nHCl = 0,6 → nH+= 0,75, nNO3- =0,15; nCL- =0,6
Fe + 4H+ + NO3- → Fe3+ + NO + 2 H2O (1)
0,15 ← 0,6 ← 0,15 → 0,15
Do sau phản ứng (1) thì Fe dư nên:
Fe + 2Fe3+ → 3Fe2+
0,05 → 0,1 → 0,15
Dung dịch X có Fe2+ (0,15 mol); Fe3+ (0,05 mol); H+ (0,15 mol); Cl- (0,6 mol)
Cô cạn dung dịch X được 2 muối: FeCl2 (0,15 mol) và FeCl3 (0,05 mol)
→ mmuối = 27,175 gam
Đáp án B
Bài 19: Hòa tan hoàn toàn 26,4 gam hỗn hợp A gồm Fe và Cu trong dung dịch HNO3, thu được 7,84 lít NO (đktc) và 800 ml dung dịch X. Cho từ từ dung dịch HCl vào X đến khi không còn khí thoát ra, thì thu được thêm 1,12 lít NO (đktc). Xác định % khối lượng của Cu trong A là:
A. 63,64% B. 36,36%
C. 45,28% D. 54,72%
Lời giải:
Hướng dẫn:
X + HCl → NO
=> trong X còn muối Fe(NO3)2
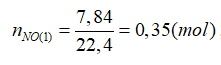
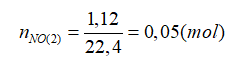
Sau khi cho HCl vào X thì thu được dung dịch trong đó chứa: Cu2+ và Fe3+
Gọi x, y lần lượt là số mol của Fe và Cu
QT cho e:
Fe→ Fe3++ 3e
Cu → Cu2++ 2e
QT nhận e:
N+5+ 3e→ NO
Theo định luật bảo toàn e: 3x+2y= 3. (0,35+0,05)
Ta có:
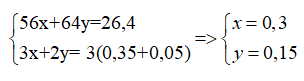
→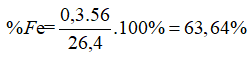
Đáp án B
Bài 20: Hòa tan 4,8 gam kim loại M hoặc hòa tan 2,4 gam muối sunfua của kim loại này, bằng dung dịch HNO3 đặc nóng dư, thì đều thu được lượng khí NO2 (sản phẩm khử duy nhất) như nhau. Xác định kim loại M?
A. Mg B. Ca C. Fe D. Cu
Lời giải:
Hướng dẫn:
(1) Phương trình phản ứng:
M + 2mH+ + mNO3- Mm+ + mNO2 + mH2O (1)
M2Sn + 4(m+n)H+ + (2m+6n)NO3- 2Mm+ + nSO42- + (2m+6n)NO2 + 2(m+n)H2O (2)
(2) Vì số mol NO2 ở hai trường hợp là bằng nhau nên ta có:
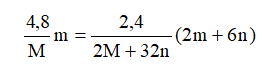
→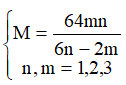
Vậy M là Cu và công thức muối là Cu2S.
Đáp án D
Bài 21: Có 4 dung dịch đựng trong 4 lọ mất nhãn là: (NH4)2SO4, NH4Cl, Na2SO4, NaOH. Nếu chỉ được phép sử dụng một thuốc thử để nhận biết 4 dung dịch trên, có thể dùng dung dịch:
A. AgNO3 B. Ba(OH)2 C. KOH D. BaCl2
Lời giải:
Đáp án B
Hướng dẫn giải :
Cho dung dịch Ba(OH)2 vào 4 dung dịch trên:
-Dung dịch làm xuất hiện kết tủa trắng và khí có mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2 → BaSO4↓+ 2NH3↑+ 2H2O
-Dung dịch nào xuất hiện chất khí mùi khai thì đó là NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2+ 2NH3↑ + 2H2O
-Dung dịch nào xuất hiện kết tủa trắng thì đó là Na2SO4
Ba(OH)2+ Na2SO4 → BaSO4 ↓ + 2NaOH
-Không có hiện tượng gì thì đó là NaOH
Bài 22: Cho các dung dịch: (NH4)2SO4, NH4Cl; Al(NO3)3; Fe(NO3)2; Cu(NO3)2. Để phân biệt các dung dịch trên chỉ có thể chỉ dùng 1 hóa chất là:
A. dung dịch NH3 B. dung dịch Ba(OH)2
C. dung dịch KOH D. dung dịch NaCl
Lời giải:
Đáp án B
Hướng dẫn giải:
Cho dung dịch Ba(OH)2 vào 5 dung dịch trên:
-Dung dịch làm xuất hiện kết tủa trắng và khí có mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2 → BaSO4↓+ 2NH3↑+ 2H2O
-Dung dịch nào xuất hiện chất khí mùi khai thì đó là NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2+ 2NH3↑ + 2H2O
-Dung dịch nào xuất hiện kết tủa keo trắng sau đó tan trong kiềm dư thì đó là Al(NO3)3
2Al(NO3)3+ 3Ba(OH)2→ 3Ba(NO3)2+ 2Al(OH)3↓
2Al(OH)3+ Ba(OH)2 → Ba(AlO2)2+ 4H2O
-Dung dịch nào làm xuất hiện kết tủa màu xanh thì đó là Cu(NO3)2
Cu(NO3)2+ Ba(OH)2→ Ba(NO3)2+ Cu(OH)2↓
-Dung dịch nào làm xuất hiện kết tủa trắng xanh sau đó hóa nâu ngoài không khí thì đó là Fe(NO3)2
Fe(NO3)2+ Ba(OH)2→ Ba(NO3)2+ Fe(OH)2↓
Bài 23: Dùng hóa chất nào sau đây để nhận biết các dung dịch: (NH4)2SO4, AlCl3, FeCl3, CuCl2, ZnCl2?
A. dung dịch NH3 B. dung dịch NaOH
C. dung dịch Ba(OH)2 D. dung dịch Ca(OH)2
Lời giải:
Đáp án A
Hướng dẫn giải:
Cho dung dịch NH3 dư lần lượt vào các dung dịch trên ta có:
-Dung dịch nào làm xuất hiện kết tủa trắng thì đó là AlCl3
AlCl3+ 3NH 3+ 3H2O → Al(OH)3 ↓ + 3NH4Cl
-Dung dịch nào làm xuất hiện kết tủa nâu đỏ thì đó là FeCl3
FeCl3+ 3NH 3+ 3H2O → Fe(OH)3 ↓ + 3NH4Cl
-Dung dịch nào làm xuất hiện kết tủa xanh lam sau đó tan trong NH3 dư tạo dung dịch xanh thẫm thì đó là CuCl2
CuCl2+ 2NH3+ 2H2O → Cu(OH)2 ↓ + 2NH4Cl
Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2
-Dung dịch nào làm xuất hiện kết tủa trắng sau đó tan trong NH3 dư tạo dung dịch trong suốt thì đó là ZnCl2
ZnCl2+ 2NH3+ 2H2O → Zn(OH)2 ↓ + 2NH4Cl
Zn(OH)2+ 4NH3 → [Zn(NH3)4](OH)2
Bài 24: Để phân biệt các dung dịch riêng biệt đựng trong các lọ mất nhãn: NH4 NO3, (NH4)2CO3, ZnCl2, BaCl2, FeCl2 chỉ cần dùng 1 thuốc thử là:
A. dung dịch NaOH B. dung dịch HCl
C. dung dịch CaCl2 D. quỳ tím
Lời giải:
Đáp án A
Hướng dẫn giải:
Cho dung dịch NaOH vào các dung dịch trên:
-Dung dịch nào làm xuất hiện chất khí có mùi khai thì đó là NH4NO3 và (NH4)2CO3
NaOH + NH4NO3 → NaNO3+ NH3+ H2O
2NaOH + (NH4)2CO3 → Na2CO3+ 2NH3+ 2H2O
-Dung dịch nào làm xuất hiện kết tủa trắng sau đó tan trong kiềm dư thì đó là ZnCl2
ZnCl2+ 2NaOH → Zn(OH)2 ↓ + 2NaCl
Zn(OH)2 + 2NaOH → Na2ZnO2+ 2H2O
-Dung dịch nào xuất hiện kết tủa trắng xanh sau đó hóa nâu ngoài không khí thì đó là FeCl2
FeCl2+ 2NaOH → Fe(OH)2 ↓ + 2NaCl
-Dung dịch nào không có hiện tượng gì thì đó là BaCl2
Lấy dung dịch BaCl2 vừa nhận được ở trên vào NH4NO3 và (NH4)2CO3:
-Dung dịch nào làm xuất hiện kết tủa trắng thì đó là (NH4)2CO3
(NH4)2CO3+ BaCl2 → BaCO3 ↓ + 2NH4Cl
-Dung dịch nào không có hiện tượng gì thì đó là NH4NO3
Bài 25: Cho 6 lọ mất nhãn chứa 6 dung dịch sau: NH4Cl, NaNO3, (NH4)2SO4, CuSO4, MgCl2, ZnCl2. Chỉ dùng hóa chất nào sau đây có thể nhận ra cả 6 chất trên?
A. quỳ tím B. dung dịch NaOH
C. dung dịch Ba(OH)2 D. NH3
Lời giải:
Đáp án C
Hướng dẫn giải:
Cho dung dịch Ba(OH)2 vào 6 dung dịch trên:
-Dung dịch làm xuất hiện kết tủa trắng và khí có mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2 → BaSO4↓+ 2NH3↑+ 2H2O
-Dung dịch nào xuất hiện chất khí mùi khai thì đó là NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2+ 2NH3↑ + 2H2O
-Dung dịch nào xuất hiện kết tủa keo trắng sau đó tan trong kiềm dư thì đó là ZnCl2
ZnCl2+ Ba(OH)2 → Zn(OH)2 ↓ + BaCl2
Zn(OH)2 + Ba(OH)2→ BaZnO2+ 2H2O
-Dung dịch nào làm xuất hiện kết tủa màu xanh thì đó là CuSO4
CuSO4+ Ba(OH)2→ BaSO4+ Cu(OH)2↓
-Dung dịch nào làm xuất hiện kết tủa trắng thì đó là MgCl2
MgCl2+ Ba(OH)2→ BaCl2+ Mg(OH)2↓
-Không có hiện tượng gì thì đó là NaNO3
Bài 26: Cho cácmẫuphânbónsau: KCl , Ca(H2PO4)2 , NH4H2PO4và NH4NO3 . Dùng 1 hóa chất nào sau đây có thể phân biệt được các mẫu phân bón trên?
A. dung dịch NaOH B. dung dịch Ca(OH)2 C. dung dịch BaCl2 D. dung dịch AgNO3
Lời giải:
Đáp án B
Hướng dẫn giải:
Cho dung dịch Ca(OH)2 vào các dung dịch trên:
-Nếu xuất hiện kết tủa trắng thì đó là Ca(H2PO4)2:
Ca(H2PO4)2+ 2Ca(OH)2 → Ca3(PO4)2+ 4H2O
-Nếu vừa xuất hiện chất khí có mùi khai và kết tủa trắng thì đó là NH4H2PO4
2NH4H2PO4 + 3Ca(OH)2 → Ca3(PO4)2+ 2NH3+ 6H2O
-Nếu xuất hiện chất khí có mùi khai thì đó là NH4NO3:
2NH4NO3+ Ca(OH)2 → Ca(NO3)2+ 2NH3+ 2H2O
Bài 27: Cho 37,8 gam hỗn hợp X gồm NH4NO3 và (NH4)3PO4 tác dụng hết với dung dịch Ba(OH)2 dư thu được 15,68 lít khí (đktc). Tính % khối lượng (NH4)3PO4 có trong hỗn hợp X?
A. 21,16% B. 78,84% C. 25,56% D. 74,44%
Lời giải:
Đáp án B
Hướng dẫn giải:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2+ 2NH3↑+ 2H2O
2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2+ 6NH3↑+6 H2O
Đặt nNH4NO3= x mol; n(NH4)3PO4= y mol → 80x + 149 y= 37,8 gam
Ta có nNH3= x + 3y = 15,68/ 22,4 mol
Giải hệ trên ta có x= 0,1 và y= 0,2 mol
→%m(NH4)3PO4= 0,2.149.100%/37,8= 78,84%
Bài 28: Có m gam hỗn hợp X gồm 2 muối NH4Cl và (NH4)3PO4 được chia thành 2 phần bằng nhau:
Phần 1: cho tác dụng với dung dịch KOH dư thu được 10,08 lít khí (đktc)
Phần 2: cho tác dụng với dung dịch AgNO3 dư thu được 63,1375 gam kết tủa
Giá trị của m là?
A. 22,6375 gam B. 45,275 gam C. 20,35 gam D. 40,7 gam
Lời giải:
Đáp án B Hướng dẫn giải: -Phần 1 : NH4Cl + KOH →KCl + NH3↑ + H2O (NH4)3PO4+ 3KOH → K3PO4+ 3NH3 ↑ + 3H2O -Phần 2 : NH4Cl + AgNO3→AgCl ↓ + NH4NO3 (NH4)3PO4+ 3AgNO3 → Ag3PO4 ↓ + 3NH4NO3 Đặt số mol NH4Cl và (NH4)3PO4 có trong mỗi phần lần lượt là x, y mol Ta có : nkhí= nNH3= x + 3y = 10,08/22,4= 0,45 mol Ta có : mkết tủa= mAgCl+ mAg3PO4= 143,5x+ 419 y= 63,1375 gam Giải hệ trên ta có : x= 0,075 mol và y= 0,125 mol → m= 2. (53,5.0,075+149.0,125)=45,275 gam
Bài 29: Nhiệt phân 40 gam NH4NO3 (rắn khan). Sau một thời gian thấy khối lượng chất rắn còn lại là 10 gam. Tính thể tích khí và hơi thu được ở đktc?
A. 22,4 lít B. 23,52 lít C. 25,2lít D. 33,6 lít
Lời giải:
Đáp án C
Hướng dẫn giải:
NHNO3 → N2O + 2H2O
x x 2x mol
Khối lượng chất rắn giảm chính là do N2O và H2O bay hơi
→mN2O+ mH2O= 44x + 2x.18= 80x = 40-10=30 gam → x= 0,375 mol
→Vkhí và hơi= 3x.22,4=25,2 lít
Bài 30: Cho 1,605 gam NH4Cl tác dụng với dung dịch Ba(OH)2 dư, đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
A. NH4H2PO4 B. (NH4)2HPO4
C. (NH4)3PO4 D. NH4H2PO4 và (NH4)2HPO4
Lời giải:
Đáp án A
Hướng dẫn giải:
2NH4Cl + Ba(OH)2 → BaCl2+ 2NH3+ 2H2O
Ta có: nNH3= nNH4Cl= 0,03 mol; nH3PO4= 0,04 mol
Ta thấy T= nNH3/ nH3PO4= 0,03/ 0,04= 0,75 ⟨1
→Muối thu được là NH4H2PO4
NH3+ H3PO4 → NH4H2PO4
Bài 31: Thổi từ từ khí NH3 đến dư vào 250 gam dung dịch CuSO4 8%. Khi thổi V1 (lít, đktc) khí NH3 thì lượng kết tủa thu được là cực đại. Tiếp tục thổi thêm V2 (lít, đktc) khí NH3 thì kết tủa vừa tan hết thu được dung dịch có màu xanh thẫm. Giá trị của V1, V2 lần lượt là:
A. 5,6 lít; 11,2 lít B. 5,6 lít; 5,6 lít
C. 2,8 lít ; 11,2 lít D. 2,8 lít ; 5,6 lít
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có : mCuSO4= 250.8%=20 gam → nCuSO4= 0,125 mol
CuSO4+ 2NH3+ 2H2O → Cu(OH)2 ↓ + (NH4)2SO4
Ta có: nNH3= 2.nCuSO4= 2.0,125= 0,25 mol → V1= 0,25.22,4= 5,6 lít
Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2
Ta có nNH3= 4nCu(OH)2= 4.nCuSO4= 4.0,125=0,5 mol → V2= 0,5.22,4 = 11,2 lít
Bài 32: Dẫn khí NH3 dư vào 500 ml dung dịch AlCl3 0,3M; CuCl2 0,2M; FeCl2 0,3 M. Sau phản ứng thu được kết tủa A. Lọc lấy kết tủa A đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là?
A. 27,65 gam B. 19,65 gam C. 18,45 gam D. 21,25 gam
Lời giải:
Đáp án B
Hướng dẫn giải:
Ta có : nAlCl3= 0,15 mol ; nCuCl2= 0,1 mol ; nFeCl2= 0,15 mol
AlCl3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4Cl
FeCl2+ 2NH3+ 2H2O → Fe(OH)2+ 2NH4Cl
CuCl2+ 4NH3 → [Cu(NH3)4]Cl2
Kết tủa A có Al(OH)3: 0,15 mol và Fe(OH)2: 0,15 mol
2Al(OH)3 → Al2O3+ 3H2O
2Fe(OH)2 +1/2 O2 → Fe2O3+2 H2O
Ta có m gam chất rắn chứa 0,075 mol Al2O3 và 0,075 mol Fe2O3
→ m= 0,075.102+ 0,075.160= 19,65 (gam)
Bài 33: Dẫn khí NH3 dư vào 100 ml dung dịch chứa Al(NO3)3 0,1M; Zn(NO3)2 0,2M và AgNO3 0,15M. Sau phản ứng thu được m gam kết tủa. Giá trị của m là?
A. 0,78 g B. 1,65 g C. 1,02 g D. 0,98 g
Lời giải:
Đáp án A
Hướng dẫn giải:
Al(NO3)3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4NO3
Zn(NO3)2+ 4NH3 → [Zn(NH3)4] (NO3)2
AgNO3+ 2NH3 → [Ag(NH3)2] NO3
Sau phản ứng m gam kết tủa có Al(OH)3
Ta có nAl(OH)3= nAl(NO3)3= 0,1.0,1= 0,01 mol → mAl(OH)3= 0,01.78= 0,78 gam
Bài 34: Hòa tan 54,44 gam hỗn hợp X gồm PCl3 và PBr3 vào nước được dung dịch Y. Để trung hòa hoàn toàn Y cần dùng 500 ml dung dịch KOH 2,6M. Tính % khối lượng của PCl3 trong X là:
A. 26,96% B. 12,125% C. 8,08% D. 30,31%
Lời giải:
Đáp án D
Hướng dẫn giải:
Gọi số mol PCl3 là x mol; số mol PBr3 là y mol
Phương trình phản ứng :
PCl3 + 3H2O → H3PO3+ 3HCl
x x 3x mol
PBr3+ 3H2O → H3PO3+ 3HBr
y y 3y mol
Dung dịch Y phản ứng với KOH
HX + KOH → KX + H2O
(3x+3y)
H3PO3 + 2KOH → K2HPO3 + 2H2O
(x+y) 2(x+y) mol
Ta có 137,5x + 271 y= 54,44; nKOH= 5x + 5y= 1,3 mol
Giải hệ trên ta có x= 0,12 và y= 0,14
%mPCl3= 30,31%
Bài 35: Thủy phân hoàn toàn 13,75 gam PCl3 thu được dung dịch X gồm hai axit. Trung hòa dung dịch X cần thể tích dung dịch NaOH 0,1M là:
A. 4 lít B. 5 lít C. 3 lít D. 6 lít
Lời giải:
Đáp án B
Hướng dẫn giải:
PCl3+ 3H2O → H3PO3 + 3HCl
0,1 0,3 0,1 0,3 mol
Trung hòa dung dịch X vào NaOH:
HCl + NaOH → NaCl + H2O
0,3 0,3 mol
H3PO3+ 2NaOH → Na2HPO3+ 2H2O
0,1 0,2 mol
Ta có nNaOH= 0,5 mol → VddNaOH = 0,5/0,1= 5 (lít)
Bài 36: Cho 2,13 gam P2O5 tác dụng với 80 ml dung dịch NaOH 1M. Sauk hi các phản ứng xảy ra hoàn toàn thu được dung dịch X chứa m gam muối. Bỏ qua sự thủy phân của các ion, giá trị của m là:
A. 4,70 B. 4,48 C. 2,46 D. 4,37
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có: nP2O5= 0,015 mol → nH3PO4= 0,03 mol
nNaOH= 0,08 mol ⟨ 0,09 mol
Áp dụng định luật bảo toàn khối lượng ta có 0,03.98 + 0,08.40= m + 0,08.18 → m= 4,7 gam
Bài 37: Cho m gam P2O5 vào 1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M đến phản ứng hoàn toàn thu được dung dịch X. Cô cạn cẩn thận X thu được 35,4 gam hỗn hợp muối khan. Giá trị của m là :
A. 21,3 gam B. 28,4 gam C. 7,1 gam D. 14,2 gam
Lời giải:
Đáp án D
Hướng dẫn giải:
Ta có: nOH-= 0,2 + 0,3= 0,5 mol →nH2O= 0,5 mol
Theo định luật bảo toàn khối lượng ta có: mH3PO4+ 0,2.40 + 0,3.56= 35,4+ 0,5.18 → mH3PO4= 19,6 gam
→ nH3PO4= 0,2 mol→ nP2O5= 0,1 mol (bảo toàn nguyên tố P)→ m= mP2O5= 0,1.142= 14,2 gam
Bài 38: Đốt cháy hoàn toàn 6,2 gam P trong khí O2 dư thu được chất rắn X. Cho X vào 200 ml dung dịch NaOH 1,25M. Khối lượng muối tạo thành trong dung dịch là:
A. 18,0 gam NaH2PO4 và 7,1 gam Na2HPO4
B. 14,2 gam Na2HPO4 và 16,4 gam Na3PO4
C. 7,1 gam Na2HPO4 và 8,2 gam Na3PO4
D. 6,0 gam NaH2PO4 và 21,3 gam Na2HPO4
Lời giải:
Đáp án A
Hướng dẫn giải:
4P + 5O2 → 2P2O5
Ta có: nP2O5= 0,5. nP= 0,1 mol; nNaOH= 0,2. 1,25= 0,25 mol
Ta có: 2⟨ T= →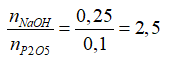
P2O4 + 2NaOH + H2O → 2NaH2PO4
x 2 x 2x mol
P2O5 + 4 NaOH → 2Na2HPO4+ H2O
y 4y 2y mol
Ta có: nP2O5= x + y = 0,1 mol; nNaOH= 2x + 4y= 0,25 mol
→ x= 0,075 mol; y = 0,025 mol
→ mNaH2PO4= 2x. 120= 18 gam; mNa2HPO4= 2y. 142= 7,1 gam
Bài 39: Hòa tan hết 0,15 mol P2O5 vào 200 gam dung dịch H3PO4 9,8% thu được dung dịch X. Cho X tác dụng hết với 750 ml dung dịch NaOH 1M thu được dung dịch Y. Hỏi trong Y có chứa những hợp chất nào của P và khối lượng tương ứng là bao nhiêu (bỏ qua sự thủy phân của các muối)?
A. 45,0 gam NaH2PO4 ; 17,5 gam Na2HPO4
B. 30,0 gam NaH2PO4; 35,5 gam Na2HPO4
C. 21,3 gam NaH2PO4; 24,6 gam Na3PO4
D. 42,6 gam Na2HPO4; 8,2 gam Na3PO4
Lời giải:
Đáp án B
Hướng dẫn giải:
nH3PO4= 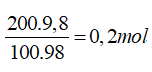
P2O5+ 3H2O → 2 H3PO4
0,15 0,3 mol
→ Tổng số mol H3PO4 là 0,3 + 0,2 = 0,5 mol; nNaOH= 0,75 mol
→Tỉ lệ T=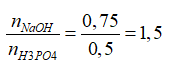
→ NaOH phản ứng với H3PO4 theo phương trình sau:
NaOH + H3PO4 → NaH2PO4 + H2O
x x x mol
2NaOH + H3PO4 → Na2HPO4 + 2H2O
2y y y mol
Ta có: nNaOH= x + 2y= 0,75 mol và nH3PO4= x + y= 0,5 mol
→ x= 0,25; y= 0,25 → mNaH2PO4= 30 gam; mNa2HPO4= 35,5 gam
Bài 40:Cho 21,30 gam P2O5 vào V lít dung dịch NaOH 1M, thu được dung dịch trong đó có chứa 38,20 gam hỗn hợp muối photphat. Giá trị của V là:
A. 0,40 lít B. 1,00 lít C. 0,60 lít D. 0,44 lít
Lời giải:
Đáp án A
Hướng dẫn giải:
P2O5+ 3H2O → 2 H3PO4
0,15 0,3 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Theo các PT ta có: nH2O= nNaOH= V (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O →40. V + 0,3.98= 38,20 + 18.V → V= 0,4 lít
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 1)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 2)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 3)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 1)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 2)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 4)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

