150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 4)
Với 150 câu trắc nghiệm Nitơ, Photpho (nâng cao - phần 4) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nitơ, Photpho (nâng cao - phần 4).
150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 4)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài 1: Cho 15,62 gam P2O5 vào 400 ml dung dịch NaOH nồng độ a M thu được dung dịch có tổng khối lượng các chất tan bằng 24,2 gam. Giá trị của a là:
A. 0,2 B.0,3 C. 0,4 D. 0,5
Lời giải:
Đáp án B
Hướng dẫn giải:
P2O5+ 3H2O → 2H3PO4
0,11 0,22mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Nếu chất tan trong dung dịch chỉ chứa các muối thì:
Theo các PT ta có: nH2O= nNaOH= 0,4a (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O →0,4a. 40 + 0,22.98= 24,2 + 0,4a.18 → a= 0,3 M
Bài 2: Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
A. 0,214 B. 0,286 C. 0,429 D. 0,143
Lời giải:
Đáp án A
Hướng dẫn giải:
P2O5+ 3H2O → 2 H3PO4
m/142 2m/142 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O= nNaOH= 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O → 0,7.40 + (2m/142).98=2,1033m + 0,7.18 →m = 21,3 gam
→nP2O5= 0,15 mol → 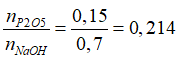
Bài 3: Đun nóng hỗn hợp Ca và P đỏ. Hoà tan sản phẩm thu được vào dd HCl dư thu được 28lít khí ở đktc. Đốt cháy khí này thành P2O5. Lượng oxit thu được tác dụng với dung dịch kiềm tạo thành 142g Na2HPO4. Xác định thành phần % về khối lượng mỗi chất trong hỗn hợp đầu.
A. 69,31%; 30,69% B. 35,57%; 64,43%
C. 30%; 70% D. 40%; 60%
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có nkhí= 1,25 mol; nNa2HPO4= 1 mol
3Ca + 2P → Ca3P2 (1)
Sản phẩm thu được có chứa Ca3P2, có thể có Ca dư hoặc P dư
Ca3P2+ 6HCl→ 3CaCl2+ 2PH3↑ (2)
Ca + 2HCl → CaCl2+ H2 ↑ (3)
2PH3+ 4O2 → P2O5+ 3H2O (4)
1 ← 0,5 mol
P2O5+ 4NaOH → 2Na2HPO4+ H2O (5)
0,5 ← 1 mol
Theo PT (2), (4), (5) ta thấy nPH3= nNa2HPO4= 1 mol ⟨1,25 mol → Sản phẩm khí phải có H2
→ nH2= 1,25- 1 = 0,25 mol→ nCa dư= nH2= 0,25 mol
Theo PT (2): nCa3P2= 0,5. nPH3= 0,5 mol
Theo PT (1): nCa pứ= 3.nCa3P2= 1,5 mol; nP pứ= 2.nCa3P2= 2.0,5= 1 mol
nCa banđầu= nCa pứ + nCa dư= 0,25 + 1,5= 1,75 mol
→Trong hỗn hợp đầu có: mCa= 1,75.40= 70 gam; mP= 1.31= 31 gam
→%mCa= 69,31%; %mP= 30,69%
Bài 4: Tiến hành nung một loại quặng chứa Ca3(PO4)2 hàm lượng 70% với C và SiO2 đều lấy dư ở 10000C. Tính lượng quặng cần lấy để có thể thu được 62 g P. Biết hiệu suất phản ứng đạt 80%.
A. 484,375 gam B. 553,6 gam C. 310 gam D. 198,4 gam
Lời giải:
Đáp án B
Hướng dẫn giải:
Ca3(PO4)2+ 3SiO2+ 5C → 3 CaSiO3+ 2P + 5 CO
Ta có nCa3(PO4)2= 0,5. nP= 0,5. 2= 1,0 mol → mCa3(PO4)2= 1. 310= 310 (gam)
→ Khối lượng quặng cần lấy là:
mquặng=
Bài 5: Tính lượng P cần dùng để có thể điều chế được 100 ml dung dịch H3PO4 31,36% (d = 1,25 gam/ml). Biết hiệu suất phản ứng đạt 100%.
A. 3,1 gam B. 6,2 gam C. 9,3 gam D. 12,4 gam
Lời giải:
Đáp án D
Hướng dẫn giải:
Khối lượng dung dịch H3PO4 là mdung dịch= V. D=100. 1,25= 125 gam
→ mH3PO4= 125.31,36/100= 39,2 gam → nH3PO4= 0,4 mol
Bảo toàn nguyên tố P ta có: nP= nH3PO4= 0,4 mol → mP= 12,4 gam
Bài 6: Lấy V(ml) dung dịch H3PO4 35% ( d = 1,25gam/ml ) đem trộn với 100 ml dung dịch KOH 2M thu được dung dịch X có chứa 14,95 gam hỗn hợp 2 muối K3PO4 và K2HPO4. Tính V?
A. 15,12 ml B. 16,8 ml C. 18,48 ml D. 18,6 ml.
Lời giải:
Đáp án B
Hướng dẫn giải:
H3 PO4 + 2KOH → K2HPO4+ 2H2O
x 2x x mol
H3PO4 + 3KOH → K3PO4 + 3H2O
y 3y y mol
Ta có: nKOH= 2x + 3y= 0,1.2= 0,2 mol
mhỗn hợp muối= 174x + 212 y= 14,95 gam
Giải hệ trên ta có: x= 0,025 mol; y = 0,05 mol → nH3PO4= x+y= 0,075 mol
→ mH3PO4= 0,075. 98= 7,35 gam →mdung dịch H3PO4 35%= 7,35.100/35= 21 (gam)
→Vdd = m/D= 21/1,25= 16,8 ml
Bài 7: Trộn lẫn 200 gam dung dịch K2HPO4 17,4% với 100 gam dung dịch H3PO4 9,8%. Tính nồng độ % của 2 muối photphat trong dung dịch thu được ?
A. 9,07%; 5,8% B. 9,07%; 6,2%
C. 8,07%; 5,8% D. 8,07%; 6,2%
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có: nK2HPO4= 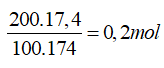
K2HPO4+ H3PO4 → 2KH2PO4
0,2 0,1 0,2 mol
Ta có: 0,2 >0,1 nên K2HPO4 dư
Ta có dung dịch thu được có chứa 0,2 mol KH2PO4 và 0,1 mol K2HPO4 dư
Ta có: mdung dịch= 200 + 100= 300 gam
C%KH2PO4 = 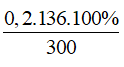
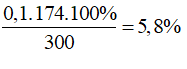
Bài 8: Khối lượng quặng photphorit chứa 65% Ca3(PO4)2 cần lấy để điều chế 150 kg photpho là (có 3% P hao hụt trong quá trình sản xuất).
A. 1,189 tấn B. 0,2 tấn C. 0,5 tấn D. 2,27 tấn
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có sơ đồ: Ca3(PO4)2 → 2P
Ta có: nCa3(PO4)2= 0,5.nP= 0,5.150/31= 75/31 (kmol) → mCa3(PO4)2= (75/31).310= 750 (kg)
→ Khối lượng Ca3(PO4)2 thực tế cần có: 750.100/97=773,2 kg
→Khối lượng quặng photphoric cần lấy là: 773,2.100/65= 1189 kg= 1,189 tấn
Bài 9: Cho m gam P2O5 vào 700 ml dung dịch KOH 1M, sau khi kết thúc phản ứng, cô cạn dung dịch thu được (3m+5,4) gam chất rắn. Giá trị của m là:
A. 14,2 B. 28,4 C. 21,3 D. 7,1
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có: nP2O5=m/142 mol
-TH1: Chất rắn khan chỉ chứa các muối
P2O5+ 3H2O → 2 H3PO4
m/142 2m/142 mol
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O= nKOH= 0,7 (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mKOH + mH3PO4= mmuối + mH2O → 0,7.56+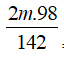
→ nH3PO4= 2m/142= 0,184 mol → T= 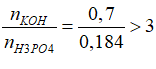
-TH2: Chất rắn khan chứa muối và KOH dư
P2O5+ 3H2O → 2 H3PO4
m/142 2m/142 mol
3KOH + H3PO4 → K3PO4 + 3H2O
6m/142 2m/142 2m/142 mol
Chất rắn khan chứa 2m/142 mol K2PO4 và (0,7- 6m/142 ) mol KOH
→ 212. 2m/142 + 56. (0,7- 2m/142 ) =3m+5,4 → m= 14,2 gam
Bài 10: Đốt cháy hoàn toàn m gam P bằng oxi rồi hòa tan hoàn toàn sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thu được dung dịch X. Cho 0,5 mol KOH vào X, sau khi các phản ứng xảy ra hoàn toàn cô cạn dung dịch thu được 943m/62 gam chất rắn. Giá trị của m là:
A. 2,17 B. 2,48 C. 3,1 D. 3,72
Lời giải:
Đáp án B
Hướng dẫn giải:
Ta có: 4P + 5O2 → 2P2O5 (1)
Cho sản phẩm cháy vào dung dịch chứa 0,1 mol H2SO4 thì:
P2O5+ 3H2O → 2H3PO4 (2)
Ta có: nH3PO4= nP= m/31 mol
Dung dịch X chứa H3PO4 và H2SO4
Cho 0,5 mol KOH phản ứng với dung dịch X:
2KOH + H2SO4 → K2SO4+ 2H2O (3)
0,2 ← 0,1 → 0,1 mol
→ Số mol KOH phản ứng với H3PO4 là 0,5- 0,2= 0,3 mol
KOH + H3PO4 → KH2PO4 + H2O (4)
2KOH + H3PO4 → K2HPO4 + 2H2O (5)
3KOH + H3PO4 → K3PO4 + 3H2O (6)
-TH1: Chất rắn sau phản ứng chỉ chứa các muối
→ nH2O= nKOH= 0,5 mol
Theo định luật bảo toàn khối lượng ta có:
mKOH+ maxit= mmuối + mH2O → 0,5.56+ 0,1.98+ 98.m/31 =943m/62+ 0,5.18 → m=2,39 gam
→nH3PO4= nP=0,077 mol →T= 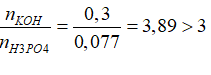
TH2: Chất rắn sau phản ứng có KOH dư
3KOH + H3PO4 → K3PO4 + 3H2O (6)
3m/31 m/31 m/31 mol
Chất rắn sau phản ứng có chứa 0,1 mol K2SO4;m/31 mol K3PO4 và (0,3- 3m/31 mol)KOH dư
→ 0,1.174+ m/31. 212+ (0,3- 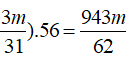
Bài 11: Cho 2,13 gam P2O5 tác dụng hết với V ml dung dịch NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X chỉ chứa 4,48 gam muối. Giá trị của V là:
A. 15 ml B. 70 ml C. 45 ml D. 60 ml
Lời giải:
Đáp án B
Hướng dẫn giải:
Ta có: nP2O5= 2,13/142= 0,015 mol
P2O5+ 3H2O → 2 H3PO4
0,015 0,03 mol
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Do trong dung dịch chỉ chứa các muối nên:
Theo các PT ta có: nH2O= nNaOH= V.1/1000= 0,001V (mol)
Áp dụng định luật bảo toàn khối lượng ta có:
mNaOH + mH3PO4= mmuối + mH2O →0,001V. 40 + 0,03.98= 4,48 + 0,001V.18 →V= 70 ml
Bài 12: Hòa tan 3,82 gam hỗn hợp X gồm NaH2PO4, Na2HPO4 và Na3PO4 vào nước dư thu được dung dịch Y. Trung hòa hoàn toàn Y cần 50 ml dung dịch KOH 1M thu được dung dịch Z. Khối lượng kết tủa thu được khi cho Z tác dụng hết với dung dịch AgNO3 dư là:
A. 20,95 gam B. 16,76 gam C. 12,57 gam D. 8,38 gam
Lời giải:
Đáp án C
Hướng dẫn giải:
Gọi số mol NaH2PO4, Na2HPO4 và Na3PO4 lần lượt là x, y, z mol
→ 120x+ 142y + 164z= 3,82 (*1)
Trung hòa Y bằng dung dịch KOH:
H2PO4-+ 2OH- → PO43-+ 2H2O (1)
x 2x x mol
HPO42-+ OH- → PO43-+ H2O (2)
y y y mol
Theo PT (1) và (2) ta có nOH-= 2x+ y= 0,05 mol (*2)
Nhân cả 2 vế của (*2) với 22 ta có 44x + 22y= 1,1 gam (*3)
Công theo vế của (*1) với (*3|) ta có: 164x +164y + 164 z= 1,1+ 3,82=4,92
→ x + y +z= 0,03 mol
Tổng số mol PO43- có trong dung dịch Z là x+ y+z (mol)
3Ag++ PO43- → Ag3PO4 ↓ (3)
Theo PT (3) ta có nAg3PO4= nPO4(3-)= x+ y+z= 0,03 mol → mAg3PO4= 0,03.419= 12,57 gam
Bài 13: Cho 11,36 gam P2O5 vào 200 ml dung dịch NaOH 0,4M và Ba(OH)2 0,3M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cô cạn dung dịch X thu được lượng rắn khan là:
A. 16,22 B. 13,52 C. 25,54 D. 20,54
Lời giải:
Đáp án C
Hướng dẫn giải:
Ta có : nP2O5= 0,08 mol ; nNaOH= 0,08 mol ; nBa(OH)2= 0,06 mol ; nOH-= 0,08 + 2.0,06= 0,2 mol
P2O5+ 3H2O → 2 H3PO4
0,08 0,16mol
Ta có T= nOH-/nH3PO4= 1,25 → 1 ⟨ T ⟨ 2 → OH- tác dụng với H3PO4 theo phương trình :
OH-+ H3PO4 → H2PO4- + H2O
x x x mol
2OH-+ H3PO4 → HPO42-+ 2H2O
2y y y mol
Ta có: nOH-= x + 2y= 0,2 mol ; nH3PO4= x + y= 0,16 mol →x= 0,12 và y= 0,04
Cô cạn dung dịch X thu được chất rắn khan chứa 0,12 mol H2PO4- và 0,04 mol HPO42- ; 0,08 mol N+ và 0,06 mol Ba2+ → mchất rắn khan= 0,12. 97+ 0,04.96+ 0,08.23 + 0,06.137=25,54 gam
Bài 14: Cho 200 ml dd H3PO4 1,5M tác dụng với 250ml dd NaOH 2M. Sau phản ứng thu được muối gì và có khối lượng là bao nhiêu?
A. 24 gam NaH2PO4 và 28,4 gam Na2HPO4 B. 12 gam NaH2PO4 và 28,4 gam Na2HPO4
C. 24 gam NaH2PO4 và 14,2 gam Na2HPO4 D. 12 gam NaH2PO4 và 14,2 gam Na2HPO4
Lời giải:
Đáp án B
Hướng dẫn giải:
Ta có: nH3PO4= 0,3 mol; nNaOH= 0,5 mol
Ta có 1⟨ T= nNaOH/ nH3PO4=1,67⟨2
→ NaOH tác dụng với H3PO4 theo 2PTHH:
NaOH + H3PO4 → NaH2PO4+ H2O
2NaOH + H3PO4 → Na2HPO4+ 2H2O
Đặt nNaH2PO4= x mol; nNa2HPO4= y mol
Ta có nH3PO4= x+ y= 0,3 mol; nNaOH= x + 2y= 0,5 mol → x=0,1; y= 0,2
→ mNaH2PO4= 12gam; mNa2HPO4=28,4 gam
Bài 15: Cho 20g dung dịch H3PO4 37,11% tác dụng vừa đủ với NH3 thì thu được 10g muối photphat amoni A. Công thức của muối A là:
A. (NH4)2HPO4 B. NH4H2PO4
C. (NH4)3PO4 D. Không xác định
Lời giải:
Đáp án A
Hướng dẫn giải:
Ta có nH3PO4= 0,07573 mol
Đặt công thức của muối amoni là (NH4)nH3-nPO4
H3PO4+ n NH3 →(NH4)nH3-nPO4
Ta có nmuối= nH3PO4= 0,07573 mol→ Mmuối A= 10/ 0,07573= 132 g/mol
→ 18n + 3-n+ 95= 132 → n= 2 → Công thức của muối A là (NH4)2HPO4
Bài 16: Một mẫu supephotphat đơn khối lượng 15,55 gam chứa 35,43% Ca(HPO4)2 còn lại CaSO4. Độ dinh dưỡng của loại phân bón trên là:
A. 21,46% B. 61,20% C. 16% D. 45,81%
Lời giải:
Đáp án A
Hướng dẫn giải:
Khối lượng Ca(H2PO4)2 có trong 15,55 gam supephotphat đơn là :
mCa(H2PO4)2= 15,55. 35,43%= 5,5 gam → nCa(H2PO4)2= 5,5/234= 0,0235 mol
Bảo toàn nguyên tố P ta có: nCa(H2PO4)2= nP2O5= 0,0235 mol → mP2O5= 0,0235. 142= 3,337 (gam)
Độ dinh dưỡng của phân lân được tính bằng %P2O5có trong phân
→Độ dinh dưỡng của phân bón trên là:
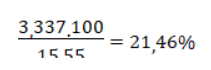
Bài 17: Phân kali (KCl) được sản xuất từ quặng sinvinit thường chỉ có 50% K2O. Hàm lượng % của KCl trong phân bón đó là:
A. 39,6 B. 69,3 C. 72,9 D. 79,3
Lời giải:
Đáp án D
Hướng dẫn giải:
Giả sử khối lượng quặng sinvinit là 100 gam
mK2O= 50 gam → nK2O = 0,532 mol
Bảo toàn nguyên tố K ta có nKCl= 1,064 mol→ mKCl= 1,064. 74,5=79,268 gam
Bài 18: Một loại phân kali chứa 59,6% KCl; 34,5% K2CO3 về khối lượng, còn lại là SiO2. Độ dinh dưỡng của loại phân bón trên là:
A. 61,10 B. 49,35 C. 50,70 D. 60,20
Lời giải:
Đáp án A
Hướng dẫn giải:
Giả sử có 100 gam phân → nKCl= 0,8 mol; nK2CO3= 0,25 mol
Bảo toàn nguyên tố K ta có nK2O= 0,65 mol
Vậy độ dinh dưỡng của phân là: 0,65. 94= 61,1%
Bài 19: Quá trình tổng hợp supephotphat kép diễn ra theo sơ đồ sau:
Ca3(PO4)2 →H3PO4 →Ca(H2PO4)2
Tính khối lượng dung dịch H2SO4 70% đã dùng để điều chế được 351 kg Ca(H2PO4)2 theo sơ đồ biến hóa trên. Biết hiệu suất của quá trình là 70%.
A. 800 kg B. 600 kg C. 500 kg D. 420 kg
Lời giải:
Đáp án B
Hướng dẫn giải:
Ta áp dụng bảo toàn nguyên tố hiđro:
nCa(H2PO4)2= 1,5 kmol → nH= 1,5.4= 6 kmol → nH2SO4= 3 kmol
→mH2SO4= 3.98= 294 (kg)→ mddH2SO4 70% = 294. 100/70= 420 (kg)
Biết hiệu suất của quá trình là 70% →mddH2SO4 70% thực tế =420.100/70= 600 (kg)
Bài 20: Người ta điều chế supephotphat đơn từ một loại bột quặng có chứa 73% Ca3(PO4)2 , 26% CaCO3, và 1% SiO2. Khối lượng dung dịch H2SO4 65% đủ để tác dụng với 100 kg bột quặng là:
A. 100 kg B. 110,1 kg C. 120 kg D. 150 kg
Lời giải:
Đáp án B
Hướng dẫn giải:
Trong 100 kg bột quặng ta có: mCa3(PO4)2= 100. 73%= 73 kg; mCaCO3= 100.26%= 26 kg
→ nCa3(PO4)2= 73/ 310 (kmol)=0,235 kmol; nCaCO3= 26/100= 0,26kmol
Ca3(PO4)2+ 2H2SO4 → Ca(H2PO4)2+ 2CaSO4
0,235 → 0,47 kmol
CaCO3+ H2SO4 → CaSO4+ CO2+ H2O
0,26 → 0,26 kmol
→ Tổng số mol H2SO4 là 0,47 + 0,26= 0,73 kmol → mH2SO4= 0,73.98= 71,54 (kg)
→ mddH2SO4 = 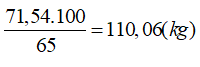
Bài 21: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52%. B. 42,25%. C. 39,76%. D. 45,75%.
Lời giải:
Đáp án B
Hướng dẫn giải:
Trong 100 gam phân supephotphat kép có: mCa(H2PO4)2= 69,62 gam
→ nCa(H2PO4)2= 69,62/243= 0,2975 mol
→ nP2O5= nCa(H2PO4)2= 0,2975 mol → mP2O5= 0,2975.142= 42,25 (gam)
Độ dinh dưỡng của phân lân được tính bằng % khối lượng của P2o5 tương ứng có trong phân.
→Độ dinh dưỡng của loại phân bón này là 42,25%
Bài 22: Một loại phân kali có thành phần chính là KCl (còn lại là các tạp chất không chứa kali) được sản xuất từ quặng sinvinit có độ dinh dưỡng 55%. Phần trăm khối lượng của KCl có trong loại phân kali đó là:
A. 95,51% B. 65,75% C. 87,18% D. 88,52%
Lời giải:
Đáp án C
Hướng dẫn giải:
Độ dinh dưỡng của phân kali được tính bằng %mK2O
Xét 100 gam phân có 55 gam KO → nK2O= 55/ 94 (mol)
Bảo toàn nguyên tố K ta có: n KCl=2.n>K2O= 2.55/94= 55/47 mol → mKCl= 87,18 gam
→%mKCl= 87,18%
Bài 23:Phân lân supephotphat kép thực tế sản xuất được thường chỉ có 40% P2o5. Hàm lượng % của canxi đihiđrophotphat trong phân bón đó là:
A. 65,9 B. 56,9 C. 32,95 D. 69,5
Lời giải:
Đáp án A
Hướng dẫn giải:
Xét 100g phân bón có 40g P2O5 →nP2O5= 40/142 = 20/71 mol
Bảo toàn P: nCa(H2PO4)2=nP2O5= 20/71 (mol)
→mCa(H2PO4)2=65,92 g →%mCa(H2PO4)2=65,92%
Bài 24: Khối lượng dung dịch H2SO4 65% cần dùng để điều chế được 500 kg supephotphat kép là:
A. 677 kg B. 700 kg C. 644 kg D. 720 kg
Lời giải:
Đáp án C
Hướng dẫn giải:
Ca3(PO4)2+3H2SO4→3CaSO4+2H3PO4(1)
Ca3(PO4)2+4H3PO4→3Ca(H2PO4)2 (2)
Theo PTHH (1): nH2SO4= 1,5. nH3PO4
Theo PTHH (2): nH3PO4= 4/3. nCa(H2PO4)2 → nH2SO4= 2.nCa(H2PO4)2= 2. 500/234=500/117 (mol)
→ mH2SO4= 500/117. 98= 418,803 kg → mddH2SO4 65% = 644 kg
Bài 25: Khi cho khí NH3 tác dụng vừa đủ với 1,96 tấn phosphoric acid khan theo tỉ lệ mol tương ứng là 3:2. Khối lượng phân amophot thu được là:
A. 24,7 tấn B. 2,47 tấn C. 1,15 tấn D. 1,32 tấn
Lời giải:
Đáp án B
Hướng dẫn giải:
NH3 + H3PO4 → NH4H2PO4
2NH3 + H3PO4→ (NH4)2HPO4
Phân amophot là hỗn hợp NH4 H2PO4 ; (NH4)2HPO4
Ta có: nH3PO4= 2.104 mol → nNH3= 1,5. nH3PO4= 3.104 mol
Theo bảo toàn khối lượng ta có:
mphân amophot= mNH3+ mH3PO4= 3.104.17+ 2.104.98=247.107 (g)= 2,47 tấn
Bài 26: Một loại phân bón amophot là hỗn hợp muối có thành phần số mol NH4H2PO4 và (NH4)2HPO4 là 1:1. Để điều chế loại phân bón này từ 6000 mol H3PO4 người ta cần dùng lượng NH3 có thể tích đo ở đkc là:
A. 201,6 m3 B. 153 m3 C. 20,6 m3 D. 32,5 m3
Lời giải:
Đáp án A
Hướng dẫn giải:
NH3 + H3PO4→ NH4 H2PO4
2NH3 + H3PO4 → (NH4)2HPO4
Đặt số mol NH4 H2PO4 là x mol → Số mol(NH4)2HPO4 là x mol
Theo 2 PT: nH3PO4= x+ x = 6000 mol → x= 3000 mol→ nNH3= x + 2x = 9000 mol
→ VNH3= 9000.22,4=201 600 lít= 201,6 m3
Bài 27: Phân đạm ure thường chỉ có 46% N. Khối lượng (kg) phân ure đủ cung cấp 70 kg N là:
A. 152,2 B. 145,5 C. 160,9 D. 200,0
Lời giải:
Đáp án A
Hướng dẫn giải:
Trong 1 phân tử (NH2)2CO, N chiếm 46% về khối lượng
→m(NH2)2CO=70.100/46=152,17 kg
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 1)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 2)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 3)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 1)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 2)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 3)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

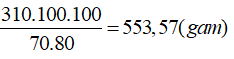



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

