100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 3)
Với 100 câu trắc nghiệm Nitơ, Photpho (cơ bản - phần 3) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nitơ, Photpho (cơ bản - phần 3).
100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 3)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài 1: Tính số mol P2O5 cần thêm vào dung dịch chứa 0,03 mol KOH để sau phản ứng thu được dung dịch chứa hai muối K2HPO4 và KH2PO4 với số mol bằng nhau:
A. 0,01 B. 0,02 C. 0,03 D. 0,04
Lời giải:
Hướng dẫn: Đáp án A
Ta có P2O5+ 3H2O→2H3PO4 (1)
H3PO4+ KOH→ KH2PO4+ H2O (2)
H3PO4+ 2KOH→ K2HPO4+2H2O (3)
Đặt số mol K2HPO4 và KH2PO4 đều là x mol
Theo PT (2), (3) : nKOH= nKH2PO4+ 2nK2HPO4=x+ 2x= 3x= 0,03
Suy ra x= 0,01 mol→ nH3PO4=nKH2PO4+ nK2HPO4= x+ x= 0,02 mol
→nP2O5= ½. nH3PO4= 0,01 mol
Bài 2: Cho sơ đồ:
X → Y→ Z→ T→ X
Các chất X, T (đều chứa nguyên tố C trong phân tử) có thể lần lượt là:
A. CO, NH4HCO3 B. CO2, NH4HCO3
C. CO2, Ca(HCO3)2 D. CO2, (NH4)2CO3
Lời giải:
Hướng dẫn: Đáp án A
CO2 (X) + 2NH3 → (NH2)2CO (Y) + H2O
(NH2)2CO +2 H2O → (NH4)2CO3 (Z)
(NH4)2CO3 → NH4HCO3 (T)+ NH3
NH4HCO3 →NH3+ CO2+ H2O
Vậy X là CO2 và T là NH4HCO3
Bài 3: Muối X là hợp chất chứa nguyên tố N. X có các phản ứng sau:
X+ NaOH→Y + Z+ A
X → T+ A
X không thể là chất nào dưới đây?
A. NH4NO3 B. NH4Cl C. NH4HCO3 D. (NH4)2HPO4
Lời giải:
Hướng dẫn: Đáp án C
-Ở đáp án A: NH4NO3 (X)+ NaOH →NaNO3(Y)+ NH3 (Z)+ H2O (A)
NH4NO3→N2O (T)+ 2H2O (A)
-Ở đáp án B: NH4Cl (X)+ NaOH →NaCl(Y)+ NH3 (A)+ H2O (Z)
NH4Cl→ NH3 (A)+ HCl (T)
-Ở đáp án C: NH4HCO3 (X)+ 2NaOH →Na2CO3(Y)+ NH3 (A)+ 2H2O (Z)
NH4HCO3→ NH3 (A)+ CO2+ H2O
PT thứ 2 tạo ra 3 sản phẩm trong khi đề chỉ cho tạo ra 2 sản phẩm → X không thể là NH4HCO3
-Ở đáp án D:(NH4)2HPO4(X)+ 3NaOH →Na3PO4(Y)+ 2NH3 (A)+ 3H2O (Z)
(NH4)2HPO4→2NH3 (A)+ H3PO4 (T)
Bài 4: Cho sơ đồ:
(NH4)2SO4→NH4Cl→ NH4NO3
Trong sơ đồ X, Y lần lượt là các chất:
A. CaCl2, HNO3 B. HCl, HNO3
C. BaCl2, AgNO3 D. HCl, AgNO3
Lời giải:
Hướng dẫn:Đáp án C
(NH4)2SO4+ BaCl2 (X) → BaSO4↓+ 2NH4Cl
NH4Cl+ AgNO3 (Y)→ AgCl↓ + NH4NO3
Đáp án A loại vì CaSO4 ít tan
Đáp án B loại vì HCl không phản ứng với (NH4)2SO4
Bài 5: Khi so sánh NH3 và NH4+, phát biểu nào sau đây không đúng?
A. Trong NH3 và NH4+, nitơ đều có số oxi hóa -3
B. Trong NH3 và NH4+, nitơ đều có cộng hóa trị 3
C. NH3 có tính bazơ, NH4+có tính axit
D. Phân tử NH3 và ion NH4+ đều có chứa liên kết cộng hóa trị
Lời giải:
Hướng dẫn: Đáp án B
Trong NH3 nitơ có cộng hóa trị 3 còn trong NH4+ thì N có cộng hóa trị là 4.
Bài 6: Trong phân tử HNO3, nguyên tử N có:
A. cộng hóa trị 4, số oxi hóa +4
B. cộng hóa trị 5, số oxi hóa +4
C. cộng hóa trị 4, số oxi hóa +5
D. cộng hóa trị 5, số oxi hóa +5
Lời giải:
Hướng dẫn: Đáp án C
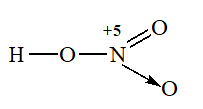
Vì xung quanh N có 4 liên kết nên N có cộng hóa trị là 4.
Bài 7: nitric acid mới điều chế không màu, khi để lâu ngày:
A. dung dịch chuyển màu vàng do HNO3 bị phân hủy thành NO2
B. dung dịch chuyển màu vàng do HNO3 bị oxi hóa bởi oxi không khí
C. dung dịch chuyển màu nâu đỏ do HNO3 bị phân hủy thành NO2
D. dung dịch chuyển màu nâu đỏ do HNO3 bị oxi hóa bởi oxi không khí
Lời giải:
Hướng dẫn: Đáp án A
Nitric acid kém bền. Ngay ở điều kiện thường, khi có ánh sáng, dung dịch nitric acid đặc bị phân hủy một phần giải phóng khí nitơ đioxit. Khí này tan trong dd axit làm dd có màu vàng.
4HNO3→4 NO2+ O2+ 2H2O
Bài 8: Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí. Tổng số hệ số của các chất (là các số nguyên tối giản) có trong phương trình khi cân bằng là:
A. 24 B. 22 C. 20 D. 29
Lời giải:
Hướng dẫn: Đáp án B
Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí.
→ Sản phẩm khử là NH4NO3
PTHH:
4Mg+10 HNO3→ 4Mg(NO3)2+ NH4NO3+ 3H2O
→Tổng hệ số các chất là 22
Bài 9: Để điều chế 50 ml dung dịch HNO3 0,1M cần dùng một thể tích khí NH3 (đktc) là:
A. 224 ml B. 112 ml C. 560 ml D. 280 ml
Lời giải:
Hướng dẫn: Đáp án B
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2→ 4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có: nNH3= nHNO3=0,05.0,1=5.10-3 mol
→ VNH3=0,112 lít=112 ml
Bài 10: Tính khối lượng dung dịch HNO3 60% điều chế được từ 112 000 lít khí NH3 (đktc). Giả thiết hiệu suất của cả quá trình là 80%?
A. 42 kg B. 525 kg C. 420 kg D. 52,5 kg
Lời giải:
Hướng dẫn: Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2→ 4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg
Bài 11: Cho cacbon tác dụng với một lượng HNO3 đặc nóng vừa đủ. Sản phẩm là hỗn hợp khí X (gồm CO2 và NO2). Tỉ khối hơi của X so với H2 là:
A. 22,5 B. 22,8 C. 22,2 D. 22,75
Lời giải:
Hướng dẫn: Đáp án B
C+ 4HNO3 đặc nóng→ CO2+ 4NO2+ 2H2O
Đặt số mol CO2 là x mol → nNO2= 4x mol
→mhh= mCO2+ mNO2= 44x+ 46.4x=228 x mol
Và nhh= nCO2+ nNO2= x+ 4x= 5x mol
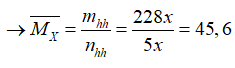
Bài 12: Cho phản ứng oxi hóa khử:
8R + 30 HNO3→ 8R(NO3)3+ 3 NxOy+ 15 H2O. Hỏi NxOy là chất nào dưới đây?
A. N2O B. N2O3 C. NO D. NO2
Lời giải:
Hướng dẫn:
Bảo toàn nguyên tố N ta có: 30 = 8.3+3x suy ra x=2
Bảo toàn nguyên tố O ta có: 30.3= 8.3.3+ 3y+15 suy ra y=1
→NxOy là N2O
Bài 13: Cho các phản ứng sau:
X (khí) + Y (khí)→ Z (khí)
Z + Cl2 → X + HCl
Z + HNO2→ T
T→ X+ 2H2O
X, Y, Z, T tương ứng với nhóm chất là:
A. N2, H2, NH3, NH4NO2 B. H2, N2, NH3, NH4NO3
C. N2, H2, NH4Cl, NH4NO3 D. N2O, H2, NH3, NH4NO3
Lời giải:
Hướng dẫn: Đáp án A
N2 (X)+ 3H2 (Y)⇄ 2NH3 (Z)
2NH3 (Z)+ 3Cl2 → N2 (X)+ 6HCl
NH3 (Z)+ HNO2→ NH4NO2 (T)
NH4NO2(T)→N2+ 2H2O
Bài 14: Trong phòng thí nghiệm, người ta cho kim loại Cu tác dụng với HNO3 đặc. Biện pháp xử lí để khí tạo thành khi thoát ra ngoài ít gây ô nhiễm môi trường nhất là:
A. nút ống nghiệm bằng bông khô
B. nút ống nghiệm bằng bông tẩm nước
C. nút ống nghiệm bằng bông tẩm dung dịch Ca(OH)2
D. nút ống nghiệm bằng bông tẩm cồn
Lời giải:
Hướng dẫn:Đáp án C
Khi cho Cu tác dụng với HNO3 đặc thì tạo thành khí NO2 độc
Để loại bỏ khí NO2 dùng bông tẩm dung dịch Ca(OH)2 để chuyển thành muối không độc
Cu+ 4HNO3→ Cu(NO3)2+ 2NO2+2 H2O
4NO2+2Ca(OH)2 → Ca(NO2)2+ Ca(NO3)2+ 2H2O
Bài 15: Cho a mol kim loại Mg phản ứng vừa đủ với dung dịch chứa b mol HNO3 thu được dung dịch chứa hai muối và không thấy khí thoát ra. Vậy a,b có mối quan hệ với nhau là:
A. 2a=5b B. 5a= 2b C. a=4b D. 4a= 3b
Lời giải:
Hướng dẫn:Đáp án B
Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí.
→ Sản phẩm khử là NH4NO3
PTHH:
4Mg+10 HNO3→ 4Mg(NO3)2+ NH4NO3+ 3H2O
a b mol
Suy ra 10a= 4b → 5a=2b
Bài 16: Cho sơ đồ tổng hợp HNO3 như sau:
NH3→NO →NO2→HNO3
Biết hiệu suất mỗi phản ứng lần lượt là 60%; 50%; 80%.
Tính khối lượng HNO3 thu được nếu ban đầu dùng 44,8 lít khí NH3 (đktc)?
A. 30,24 gam B. 75,60 gam
C. 50,40 gam D. 15,12 gam
Lời giải:
Hướng dẫn: Đáp án A
Theo bảo toàn nguyên tố N ta có;
nHNO3= nNH3= 2 mol → mHNO3=126 gam
Do hiệu suất mỗi phản ứng lần lượt là 60%; 50%; 80% nên
mHNO3 thực tế thu được= 126. 60%.50%.80%= 30,24 gam
Bài 17: Hòa tan hoàn toàn 8,4 gam Fe vào dung dịch HNO3 đặc nóng dư thu được V lít khí NO2 duy nhất ở đkc. Giá trị của V là:
A. 11,2 lít B. 5,6 lít C. 3,36 lít D. 10,08 lít
Lời giải:
Hướng dẫn: Đáp án D
Fe+6 HNO3 đặc → Fe(NO3)3+ 3NO2+3 H2O
Ta có : nNO2= 3.nFe= 3. 8,4/56=0,45 mol → V=10,08 lít
Bài 18: Hòa tan hoàn toàn 12,0 gam hỗn hợp X gồm Fe và Cu vào dung dịch HNO3 dư thu được 11,2 lít (đktc) khí NO2 duy nhất. Xác định %khối lượng Fe trong hỗn hợp?
A. 46,67% B. 53,33% C. 40,45% D.59,55%
Lời giải:
Hướng dẫn: Đáp án A
Fe+6 HNO3 đặc → Fe(NO3)3+ 3NO2+3 H2O
Cu+ 4HNO3→ Cu(NO3)2+ 2NO2+2 H2O
Đặt nFe= xmol; nCu= y mol
Ta có mhhX= 56x+ 64y= 12,0
Số mol khí NO2 là nNO2= 3x+ 2y= 0,5 mol
Giải hệ có x= 0,1; y=0,1 → %mFe=46,67%
Bài 19: Để trung hòa hoàn toàn dung dịch thu được khi thủy phân 4,5375 gam một photpho trihalogenua cần 55 ml dung dịch NaOH 3M. Halogen là nguyên tố nào sau đây?
A. Flo B. Clo C. Brom D. Iot
Lời giải:
Hướng dẫn: Đáp án B
Đặt công thức của photpho trihalogenua là PX3
PX3+ 3H2O → 3HX+ H3PO3 (1)
Đặt số mol PX3 là x mol → nHX= 3x mol; nH3PO3=x mol
HX+ NaOH → NaX + H2O (2)
H3PO3+ 2NaOH → Na2HPO3+ 2H2O (3)
Theo PT (2) và (3) có nNaOH= nHX+ 2nH3PO3=3x+ 2x= 5x mol= 0,055.3
→ x=0,033 mol→ MPX3= m/n= 4,5375/ 0,033=137,5 → X=35,5 Nên X là Clo
Bài 20: Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 dư thu được 6,72 lít (đktc) khí X gồm NO và NO2 có dX/H2= 19 và dung dịch Y (không chứa NH4+). Tính m ?
A. 5,6 gam B. 11,2 gam C. 16,8 gam D. 22,4 gam
Lời giải:
Hướng dẫn: Đáp án B
Đặt số mol NO là x mol; số mol NO2 là y mol
ta có nX= nNO+ nNO2= x+y= 6,72/22,4= 0,3 mol
mX= mNO+ mNO2= 30x+ 46y= 19.2.0,3 (gam)
Giải hệ trên ta được x= 0,15 và y= 0,15
QT cho e:
Fe → Fe3++ 3e
QT nhận e:
N+5+ 3e→ NO
0,45← 0,15
N+5+ 1e→ NO2
0,15← 0,15
→Tổng số mol e nhận= 0,45+ 0,15= 0,60 mol
Theo định luật bảo toàn electron: ne cho= ne nhận= 0,60 mol
→nFe= 0,60/3= 0,2 mol → mFe=11,2 gam
Bài 21: Hòa tan hoàn toàn hỗn hợp X gồm 0,11 mol Al và 0,15 mol Cu vào dung dịch HNO3 thì thu được 1,568 lít (đktc) hỗn hợp Y gồm 2 khí là NO và N2 và dung dịch Z chứa 2 muối. Số mol HNO3 đã tham gia phản ứng là:
A. 0,63 mol B. 0,70 mol C. 0,77 mol D. 0,76 mol
Lời giải:
Hướng dẫn: Đáp án D
QT cho e:
Al → Al3++ 3e
0,11→ 0,33
Cu → Cu2++ 2e
0,15→ 0,3
Tổng số mol e cho: ne cho= 0,33+ 0,3= 0,63 mol
nY= 0,07 mol
Đặt số mol khí NO là x mol. Khí N2 có số mol là y mol→ x+y= 0,07 (1)
QT nhận e:
NO3-+ 3e + 4H+→ NO + 2H2O (1)
3x← x mol
2NO3-+ 10e+ 12H+ →N2+ 6 H2O (2)
10y← y mol
Tổng số mol e nhận là 3x+10 y mol
Theo ĐL bảo toàn e: ne cho= ne nhận nên 3x+10y=0,63 (2)
Từ (1) và (2) ta có x= 0,01 và y= 0,06
Theo 2 bán phản ứng (1) và (2) ta có: nH+= 4x+ 12y=0,76 mol= nHNO3
Bài 22: P2O5 có tính chất hóa học là phản ứng được với:
1. Nước 2. Sắt 3. NaOH 4. dd AgNO3 5.HNO3
Cho biết tính chất nào đúng?
A. 1, 2, 5, 4 B. 1, 2, 3
C. 1, 3, 5 D. 1, 3, 4
Lời giải:
Hướng dẫn: Đáp án D
1) P2O5+ 3H2O→ 2 H3PO4
3) P2O5+ 3H2O→ 2 H3PO4
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HPO4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
4) P2O5+ 3H2O→ 2 H3PO4
3AgNO3+ H3PO4→ Ag3PO4+ 3HNO3
Bài 23: Axit H3PO4 không phản ứng được với:
1. H2O 2. NaOH 3. HCl 4. NaCl 5. Cu(OH)2
A. 1, 2, 3 B. 2, 3, 4 C. 1, 2, 4 D. 1, 3, 4
Lời giải:
Hướng dẫn: Đáp án D
Axit H3PO4 không phản ứng được với: H2O, HCl, NaCl
Axit H3PO4 phản ứng được với: NaOH; Cu(OH)2
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HP O4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
2H3PO4+ 3Cu(OH)2 → Cu3(PO4)2+6 H2O
Bài 24: Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng trong dung dịch chứa các muối:
A. KH2PO4 và K2HPO4 B. KH2PO4 và K3PO4
C. K2HPO4 và K3PO4 D. KH2PO4, K2HPO4, K3PO4
Lời giải:
Hướng dẫn: Đáp án A
Ta có: nKOH= 0,15 mol; nH3PO4= 0,1 mol
Ta có: T= nKOH/ nH3PO4= 1,5→ Xảy ra các PT:
H3PO4+ KOH →KH2PO4+ H2O
H4PO4+ 2KOH → K2HP O4+ 2H2O
Bài 25: Để điều chế được 24,7 kg amophot (tỉ lệ mol các muối trong amophot là 1:1) thì khối lượng H3PO4 nguyên chất cần dùng là:
A. 9,8 kg B. 14,7 kg C. 16,8 kg D. 19,6 kg
Lời giải:
Hướng dẫn: Đáp án D
Amophot gồm: NH4H2PO4 (x mol) và (NH4)2HPO4 (x mol)
→mAmophot=115x + 132x= 247x= 24,7.103 (gam)
→x= 100 mol
NH3+ H3PO4 → NH4H2PO4
2NH3+ H3PO4 →(NH4)2HPO4
Bảo toàn nguyên tố P ta có: nH3PO4= nNH4H2PO4+ n(NH4)2HPO4= 2x= 200 mol
→H3PO4=19600 gam=19,6 kg
Bài 26: Một mẫu supephotphat đơn khối lượng 15,55 gam chứa 35,43% Ca(HPO4)2 còn lại là CaSO4. Độ dinh dưỡng của loại phân bón trên là:
A. 21,69% B. 61,20% C. 16% D. 45,81%
Lời giải:
Hướng dẫn: Đáp án A
Khối lượng Ca(HPO4)2 là: mCa(HPO4)2= 15,55.35,43%=5,509365 gam
→nCa(HPO4)2=0,0237 mol→ nP2O5= nCa(HPO4)2=0,02375 mol (Bảo toàn nguyên tố P)
Độ dinh dưỡng của loại phân bón trên là:
%P2O5= mP2O5.100%/mphân= 0,02375.142.100%/15,55= 21,69%
Bài 27: Một loại phân ure có chứa 95% (NH2)2CO, còn lại là (NH4)2CO3. Độ dinh dưỡng của loại phân này là:
A. 46,00% B. 43,56% C. 44,33% D. 45,79%
Lời giải:
Hướng dẫn: Đáp án D
Giả sử có 100 gam phân ure → m(NH2)2CO= 95 gam; m(NH4)2CO3= 5 gam
→ n(NH2)2CO= 19/12 mol; n(NH4)2CO3= 5/96 mol
→ nN= 2. n(NH2)2CO +2n(NH4)2CO3=157/48 mol (Bảo toàn nguyên tố N)
Độ dinh dưỡng của phân đạm được tính bằng hàm lượng % N trong phân.
Độ dinh dưỡng của phân đạm là:
%N= mN.100%/mphân= 157/48. 14.100%: 100= 45,79%
Bài 28: Khối lượng NH3 và dung dịch HNO3 45% đủ để điều chế 100 kg phân đạm có 34% N là:
A. 20,6 kg và 76,4 kg B. 7,225 kg và 26,775 kg
C. 20,6 kg và 170 kg D. 7,75 kg và 59,5 kg
Lời giải:
Hướng dẫn: Đáp án C
Khối lượng N có trong phân đạm là 100.34%= 34 kg= 34 000 gam
→nN= 17 000/7 mol
NH3+ HNO3→ NH4NO3
Đặt nNH3= nHNO3= x mol→ bảo toàn nguyên tố N ta có:
nN= x+ x= 17 000/7 → x=8500/7 mol
→mNH3= 20642 gam= 20,6 kg
và mddHNO3 45% = (8500/7).63.100/45=170 000 gam= 170 kg
Bài 29: Phân đạm ure thường chỉ chứa 46% N. Khối lượng (kg) ure đủ cung cấp 70 kg N là:
A. 152,2 B. 145,5 C. 160,9 D. 200,0
Lời giải:
Hướng dẫn: Đáp án A
Phân đạm ure thường chỉ chứa 46% N
→ Khối lượng ure là mure= mN.100/46= 70.100/46=152,2 kg
Bài 30: Cho 15,62 gam P2O5 vào 400 ml dung dịch NaOH aM (hai chất đều phản ứng hết) thu được dung dịch có tổng khối lượng các chất tan bằng 24,2 gam. Giá trị của a là:
A. 0,2 B. 0,3 C. 0,4 D. 0,5
Lời giải:
Hướng dẫn: Đáp án B
P2O5+ 3H2O→ 2 H3PO4
→ nH3PO4= 2. nP2O5= 2.15,62/142= 0,22 mol
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HP O4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
Theo các phương trình trên ta có: nH2O =nNaOH= 0,4a mol
Theo ĐLBT khối lượng:
mH3PO4+ mNaOH=mmuối+ mH2O
→ 0,22.98+ 0,4a.40=24,2+ 18.0,4a →a= 0,3 mol
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 1)
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải (cơ bản - phần 2)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 1)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 2)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 3)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải (nâng cao - phần 4)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

