Lý thuyết về tính chất của Đồng, Bạc, Vàng, Niken, Kẽm, Thiếc, Chì (hay, chi tiết nhất)
Bài viết Lý thuyết về tính chất của Đồng, Bạc, Vàng, Niken, Kẽm, Thiếc, Chì hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm về Đồng, Bạc, Vàng, Niken, Kẽm, Thiếc, Chì.
Lý thuyết về tính chất của Đồng, Bạc, Vàng, Niken, Kẽm, Thiếc, Chì
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài 38: Luyện tập gồm Tính chất hóa học của crom, đồng và hợp chất của chúng - Cô Nguyễn Thị Thu (Giáo viên VietJack)
I. Đồng và hợp chất
1. Đồng
- Đồng thuộc nhóm IB, có chu kì 4, có số hiệu nguyên tử là 29.
- Cấu hình electron nguyên tử của Cu: [Ar]3d104s1; Cu+: 3d10; Cu2+: 3d9.
- Tính chất vật lí: là kim loại màu nâu đỏ, dẻo, dễ kéo sợi và dát mỏng, dẫn điện, dẫn nhiệt tốt.
Hợp kim của đồng như đồng thau (Cu – Zn); đồng bạch (Cu–Ni); đồng thanh (Cu – Sn); … có rất nhiều ứng dụng trong công nghiệp và đời sống.
- Tính chất hóa học: là kim loại có tính khử yếu [tác dụng với phi kim (O2, S, Cl2), dung dịch muối (Ag+, Hg2+), axit có tính oxi hóa mạnh: H2SO4 đặc nóng; HNO3].
Một số phương trình minh họa:
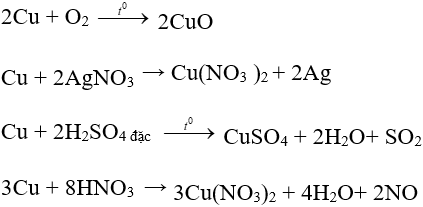
2. Một số hợp chất của đồng
- CuO: là chất rắn màu đen; có tính oxi hóa; được điều chế bằng cách nhiệt phân Cu(OH)2, Cu(NO3)2, CuCO3, Cu(OH)2, …
- Cu(OH)2: là chất rắn màu xanh; có tính bazơ, không tan trong nước nhưng tan dễ trong dung dịch axit, tan trong dung dịch NH3 tạo ra nước Svayde; được điều chế từ dung dịch muối đồng (II) và dung dịch bazơ.
- CuSO4 dạng khan là chất rắn màu trắng, trạng muối hidrat CuSO4.5H2O có màu xanh.
II. Sơ lược về các kim loại Ag, Au, Ni, Zn, Sn, Pb
1. Bạc
- Thuộc nhóm IB, chu kì 5, số hiệu nguyên tử là 47.
- Cấu hình electron nguyên tử: [Kr]4d105s1.
- Thường có số oxi hóa +1 trong các hợp chất.
- Có tính khử rất yếu: không tác dụng với dung dịch axit HCl và H2SO4 loãng; tác dụng với dung dịch axit có tính oxi hóa mạnh như HNO3 và H2SO4 đặc nóng; bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hydrogen sulfide.
Ví dụ:
Ag + 2HNO3 đặc → AgNO3 + NO2 + H2O
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
2. Vàng
- Thuộc nhóm IB, chu kì 6, số hiệu nguyên tử là 79.
- Cấu hình electron nguyên tử: [Xe]4f145d106s1.
- Thường có số oxi hóa +3 trong các hợp chất.
- Có tính khử rất yếu: không bị oxi hóa trong không khí ở mọi nhiệt độ, không bị hòa tan trong axit kể cả axit HNO3 nhưng tan trong nước cường toan (hỗn hợp tỉ lệ HNO3: HCl đặc = 1:3), dung dịch muối xianua của kim loại kiềm (NaCN), thủy phân tạo hỗn hống.
Au + HNO3 + 3HCl → AuCl3 + 2H2O + NO
4Au + 8NaCN + O2 + 2H2O → 4NaAu(CN)2 + 4NaOH
3. Niken
- Thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28.
- Cấu hình electron nguyên tử: [Ar]3d84s2.
- Thường có số oxi hóa +2 trong các hợp chất.
- Có tính khử yếu: tác dụng với phi kim ở nhiệt độ cao; tác dụng với dung dịch axit; tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường.
Ví dụ:
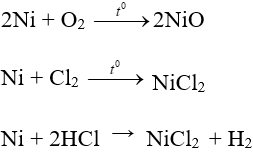
- Niken được dùng mạ lên sắt để làm đẹp, chống gỉ và còn được dùng làm chất xúc tác.
4. Kẽm
- Thuộc nhóm IIB, chu kì 4, số hiệu nguyên tử là 30.
- Cấu hình electron nguyên tử: [Ar]3d104s2.
- Thường có số oxi hóa +2 trong các hợp chất.
- Có tính khử mạnh hơn sắt: tác dụng với phi kim ở nhiệt độ cao; tác dụng với dung dịch muối và axit; bền với nước và không khí ở nhiệt độ thường.
Ví dụ:
Zn + Cl2 → ZnCl2
Zn + H2SO4 → ZnSO4 + H2
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
- Kẽm được mạ lên tôn để chống gỉ và còn được dùng làm pin khô.
5. Chì
- Thuộc nhóm IVA, chu kì 6, số hiệu nguyên tử là 82.
- Cấu hình electron nguyên tử: [Xe]4f145d106s26p2.
- Thường có số oxi hóa là +2, +4 nhưng số oxi hóa +2 phổ biến và bền hơn.
- Có tính khử yếu: tác dụng với phi kim ở nhiệt độ cao, không tác dụng với các dung dịch HCl, H2SO4 loãng do muối (PbCl2 và PbSO4) không tan bao bọc ngoài kim loại; tan được trong dung dịch HNO3 và H2SO4 đặc nóng do tạo được muối tan Pb(HSO4)2; tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường; tan chậm trong dung dịch kiềm nóng.
- Được dùng để chế tạo bản cực acquy, đầu đạn và chế tạo thiết bị chống tia phóng xạ.
6. Thiếc
- Thiếc thuộc nhóm IVA, chu kì 5, số hiệu nguyên tử là 50.
- Cấu hình electron nguyên tử: [Kr]4d105s25p2.
- Có số oxi hóa +2 và +4 trong các hợp chất.
- Có tính khử yếu hơn Ni: tác dụng với phi kim ở nhiệt độ cao; tác dụng chậm với dung dịch axit (HNO3 loãng: Sn → Sn2+; H2SO4, HNO3 đặc: Sn → Sn4+); tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường; bị hòa tan trong dung dich kiềm đặc.
- Sn được mạ lên sắt tây để chống gỉ và được dùng làm thiếc hàn.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 12 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Hợp chất của sắt
- Lý thuyết Hợp kim của sắt
- Lý thuyết Đồng và hợp chất của đồng
- Dạng 1: Chuỗi phản ứng hóa học của sắt, crom
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

