Đồng vị của Lutetium (Lu) (chi tiết nhất)
Bài viết đồng vị của Lutetium hay đồng vị của Lu chi tiết nhất giúp học sinh các cấp có thêm thông tin về đồng vị của Lu từ đó học tốt môn Hóa hơn.
Đồng vị của Lutetium (Lu) (chi tiết nhất)
Cho đến năm 2020, đã có 118 nguyên tố hóa học được xác định, trong đó có 94 nguyên tố có nguồn gốc tự nhiên, còn lại là nguyên tố nhân tạo. Mỗi nguyên tố hóa học đều có nhiều đồng vị, bài viết sau sẽ cung cấp cho các em kiến thức về đồng vị của lutetium.
I. Đồng vị của lutetium
- Luteti tự nhiên gồm 1 đồng vị ổn định 175Lu (chiếm 97,41%) và một đồng vị phóng xạ beta 176Lu có chu kỳ bán rã 3,78×1010 năm (2,59%).
|
Đồng vị |
Nguồn tự nhiên |
Chu kỳ bán rã |
Kiểu phân rã |
Năng lượng phân rã (MeV) |
Sản phẩm phân rã |
|
175Lu |
97,41% |
Bền |
|||
|
176Lu |
2,59% |
3,78.1010 năm |
β- |
1,193 |
176Hf |
- 33 đồng vị phóng xạ đã được nhận biết, trong đó đồng vị tự nhiên ổn định nhất là 176Lu, và các đồng vị tổng hợp 174Lu có chu kỳ bán rã 3,31 năm, và 173Lu là 1,37 năm. Tất cả các đồng vị phóng xạ còn lại có chu kỳ bán rã nhỏ hơn 9 ngày, và đa số trong đó có chu kỳ bán rã nhỏ 30 phút.Nguyên tố này có 18 meta state, với trạng thái ổn định nhất là 177mLu (T½=160,4 ngày), 174mLu (T½=142 ngày) và 178mLu (T½=23,1 phút).
- Nguyên tử khối trung bình của lutetium được tính như sau:
II. Kiến thức mở rộng
1. Ứng dụng của một số đồng vị
- Đồng vị 176Lu được sử dụng để định tuổi thiên thạch.
- Lutetium-177 (177Lu) được dùng làm hạt nhân phóng xạ bị bắn phá trong thí nghiệm điều trị các khối u thần kinh nội tiết
2. Công thức tính nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị, có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
X, Y, Z …: lần lượt là số khối của các đồng vị.
x, y, z… là phần trăm số nguyên tử của các đồng vị tương ứng.
III. Bài tập minh họa
Câu 1: Khối lượng nguyên tử của B bằng 10,81. B trong tự nhiên gồm hai đồng vị 10B và 11B. Hỏi có bao nhiêu phần trăm 11B trong axit boric H3BO3. Cho H3BO3 = 61,81.
A. 14,42%.
B. 19%.
C. 81%.
D. 24,4%.
Hướng dẫn giải
Đáp án đúng là: A
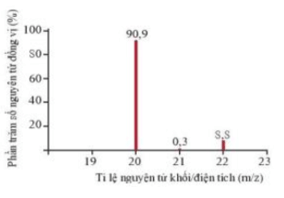
Câu 2. Phổ khối, hay phổ khối lượng chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như hình dưới. Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích Z của các ion đồng vị neon đều bằng +1). Tính nguyên tử khối trung bình của Ne.
A. 20,297.
B. 21,79.
C. 20,179.
D. 20,719.
Hướng dẫn giải
Đáp án đúng là: C
Câu 3: Nguyên tố A có hai đồng vị X và Y. Tỉ lệ số nguyên tử của X: Y là 45: 455. Tổng số hạt trong nguyên tử của X bằng 32. Trong Y số hạt mang điện gấp 2 lần số hạt không mang điện. Tính nguyên tử khối trung bình của A.
A. 21,18.
B. 20,18.
C. 20,81.
D. 28,10.
Hướng dẫn giải
Đáp án đúng là: B
Xem thêm các bài viết về đồng vị của các nguyên tố hóa học hay khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



