Al + HNO3 loãng → Al(NO3)3 + N2 + H2O | Al + HNO3 ra N2
Phản ứng Al + HNO3 loãng ra N2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Al có lời giải, mời các bạn đón xem:
10Al + 36HNO3 loãng → 10Al(NO3)3 + 3N2 ↑ + 18H2O
1. Phương trình hóa học của phản ứng Al tác dụng với HNO3
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
2. Điều kiện để Al tác dụng với HNO3
Dung dịch HNO3 loãng.
3. Cách tiến hành thí nghiệm
Nhỏ HNO3 vào ống nghiệm có chứa sẵn 1 lá nhôm.
4. Hiện tượng phản ứng
Nhôm (Al) tan dần trong dung dịch, thấy xuất hiện sủi bọt khí.
5. Cách lập phương trình hóa học
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa – khử:
Chất khử: Al; chất oxi hóa: HNO3.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
- Quá trình oxi hóa:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa
Bước 4: Điền hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
6. Mở rộng tính chất hoá học của nhôm
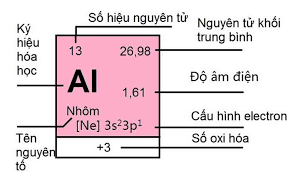
6.1. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Nhôm có số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3 của bảng tuần hoàn.
- Cấu hình electron: 1s22s22p63s23p1, hay [Ne]3s23p1 .
- Nhôm dễ nhường cả 3 electron hóa trị nên có số oxi hóa +3 trong các hợp chất.
6.2. Tính chất vật lý
- Nhôm là kim loại màu trắng bạc, nóng chảy ở 660oC, khá mềm, dễ kéo sợi, dễ dát mỏng.
- Nhôm là kim loại nhẹ (D = 2,7 g/cm3); dẫn điện, dẫn nhiệt tốt.
6.3. Tính chất hóa học
Nhôm là kim loại có tính khử mạnh (chỉ sau kim loại kiềm và kim loại kiềm thổ):
Al → Al3++ 3e
a. Tác dụng với phi kim
Nhôm khử dễ dàng các phi kim thành ion âm.
- Với oxi: Ở điều kiện thường, nhôm bền trong không khí do có lớp oxit rất mỏng, bền bảo vệ. Khi đốt, bột nhôm cháy trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt:
4Al + 3O2 2Al2O3
- Bột nhôm tự bốc cháy khi tiếp xúc với clo
2Al + 3Cl2 → 2AlCl3
b. Tác dụng với axit
- Nhôm khử dễ dàng ion H+ trong dung dịch HCl và H2SO4 loãng thành H2.
2Al + 6HCl → 2AlCl3 + 3H2
- Al tác dụng mạnh với axit HNO3 loãng, H2SO4 đặc, nóng; HNO3 đặc, nóng.
Ví dụ:
Al + 4HNO3 loãng → Al(NO3)3 + NO + H2O
2Al + 6H2SO4 đặc Al2(SO4)3 + 3SO2 + 6H2O
- Nhôm không tác dụng với axit H2SO4 đặc, nguội; HNO3 đặc, nguội.
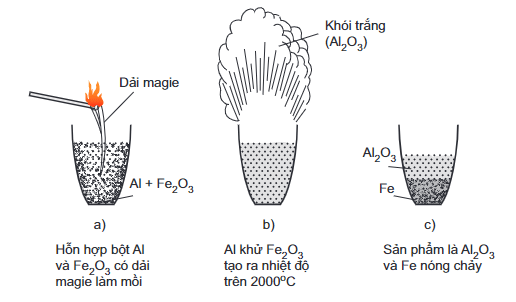
c. Tác dụng với oxit kim loại – Phản ứng nhiệt nhôm
- Ở nhiệt độ cao, Al khử được nhiều ion kim loại trong oxit như (Fe2O3, Cr2O3,CuO…) thành kim loại tự do.
- Ví dụ:
2Al + Fe2O3 Al2O3 + 2Fe.
d. Tác dụng với nước
- Vật bằng nhôm không tác dụng với H2O ở bất kì nhiệt độ nào vì có lớp oxit bảo vệ. Nếu phá bỏ lớp bảo vệ, nhôm khử được nước ở nhiệt độ thường, nhưng phản ứng nhanh chóng dừng lại vì tạo kết tủa Al(OH)3.
e. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 6H2O →2Na[(Al(OH)4] + 3 H2↑
Phương trình ion thu gọn:
2Al + 2OH- + 6H2O → 2[(Al(OH)4]- + 3 H2↑
Với chương trình cơ bản có thể viết:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3 H2 ↑
6.4. Ứng dụng và trạng thái tự nhiên
a. Ứng dụng
- Nhôm và hợp kim của nhôm có ưu điểm nhẹ, bền đối với không khí và nước nên được dùng làm vật liệu chế tạo tên lửa, máy bay, ô tô, tàu vũ trụ …
- Nhôm và hợp kim của nhôm có màu trắng bạc, đẹp nên dùng để xây dựng nhà cửa, trang trí nội thất.
- Nhôm nhẹ, dẫn điện tốt nên được dùng làm dây dẫn điện.
- Nhôm dẫn điện tốt, ít bị gỉ, không độc nên được dùng làm dụng cụ nhà bếp.
- Bột nhôm trộn với oxit sắt (hỗn hợp tecmit) dùng để hàn đường ray.
b. Trạng thái tự nhiên
- Trong tự nhiên nhôm chỉ tồn tại dưới dạng hợp chất.
- Nhôm là nguyên tố phổ biến thứ 3 trong vỏ trái đất, sau oxi và silic.
- Hợp chất của nhôm có trong đất sét, mica, boxit, criolit …
6.5. Sản xuất nhôm
Trong công nghiệp nhôm được sản xuất bằng cách điện phân nhôm oxit nóng chảy.
a. Nguyên liệu
Quặng boxit, thành phần chính: Al2O3.2H2O
b. Điện phân nhôm oxit nóng chảy
+ Ở catot (cực âm): Al3+ + 3e → Al
+ Ở anot (cực dương): 2O2- → O2 + 4e
Phương trình điện phân: 2Al2O3 4Al + 3O2
7. Bài tập vận dụng liên quan
Câu 1:Kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống là
A. Fe. B. Ag. C. Cu. D. Al.
Hướng dẫn giải
Đáp án D
+ Nhôm (Al) là kim loại màu trắng bạc, mềm, dẻo, nhẹ, dẫn điện dẫn nhiệt tốt.
+ Al được ứng dụng rộng rãi trong đời sống: sản xuất hợp kim siêu nhẹ làm máy bay, tên lửa; trang trí; chế tạo dây dẫn điện; hàn đường ray.
Câu 2: Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được hỗn hợp gồm 0,12 mol khí NO2 và 0,08 mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
A. 3,24. B. 8,1. C. 6,48. D. 10,8.
Hướng dẫn giải
Đáp án A
Bảo toàn số mol electron:
→ 3nAl = + 3nNO
→ 3.nAl = 0,12 + 3.0,08
→ nAl = 0,12 mol
→ mAl = 0,12.27 = 3,24g
Câu3: Số electron lớp ngoài cùng của nguyên tử Al là
A. 4. B. 3. C. 1. D. 2.
Hướng dẫn giải
Đáp án B
Cấu hình electron của nguyên tử nguyên tố Al (Z = 13): 1s22s22p63s23p1
Câu 4: Hòa tan hoàn toàn m gam Al bằng dung dịch NaOH dư thu được 5,6 lít H2 (đktc). Giá trị của m là
A. 2,7 B. 4,5 C. 5,4 D. 6,75
Hướng dẫn giải
Đáp án B
= 0,25 mol
Áp dụng định luật bảo toàn electron:
3.nAl = 2.
→ mAl = .27 = 4,5 gam
Câu 5: Hòa tan hết m gam bột Al trong dung dịch HCl thu được 2,24 lít H2 (đktc). Nếu hòa tan 2m gam bột Al trong dung dịch Ba(OH)2 được V lít H2 (đktc). Giá trị của V là
A, 1,12 B. 2,24 C. 3,36 D. 4,48
Hướng dẫn giải
Đáp án D
Đặt số mol Al trong m gam Al bằng x (mol)
Bảo toàn electron cho phản ứng của Al với HCl
3.nAl = 2.
→ 3x = 2.
Bảo toàn electron cho phản ứng của Al với Ba(OH)2
→ 3.2x = 2.
→ = 2.
→ = 2.0,1 = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít
Câu 6: Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Hướng dẫn giải
Đáp án A
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước tạo ra khí H2
2Al + 6H2O → 2Al(OH)3 + 3H2
Câu 7:Kim loại Al không phản ứng với dung dịch
A.HNO3 đặc, nguội. B. Cu(NO3)2. C. HCl. D. KOH.
Hướng dẫn giải
Đáp án A
Al không phản ứng với HNO3 đặc, nguội, H2SO4 đặc nguội
Câu 8: Cho 3,82 gam hợp kim Ba, Al vào nước dư chỉ thu được dung dịch chứa duy nhất một muối. Khối lượng Ba là
A. 3,425 gam. B. 1,644 gam.
C. 1,370 gam. D. 2,740 gam.
Hướng dẫn giải
Đáp án D
Công thức muối Ba(AlO2)2
nAl = 2nBa (1)
Lại có: mAl + mBa = 3,82
→ 27.nAl + 137.nBa = 3,82 (2)
nAl = 0,04 mol; nBa = 0,02 mol
→ mBa = 0,02.137 = 2,740 gam
Câu 9:Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe2O3 nung nóng. B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe3O4 nung nóng. D. Al tác dụng với axit H2SO4 đặc nóng.
Hướng dẫn giải
Đáp án D
Phản ứng nhiệt nhôm là phản ứng cho nhôm tác dụng với oxit kim loại ở nhiệt độ cao.
Câu 10:Lấy hỗn hợp gồm Al, Al2O3 và Fe2O3 ngâm trong dung dịch NaOH dư. Phản ứng xong, chất bị hoà tan là:
A. Al, Al2O3. B. Fe2O3, Fe. C. Al, Fe2O3.D. Al, Al2O3, Fe2O3.
Hướng dẫn giải
Đáp án A
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH →2NaAlO2 + H2O.
Câu 11: Cho phương trình phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Tỉ lệ a : b là
A. 1 : 3. B. 2 : 3. C. 2 : 5. D. 1 : 4
Hướng dẫn giải
Đáp án D
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
→ a : b = 1 : 4
Câu 12:Cho 3,24 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là:
A.2,688 lít. B. 4,032 lít.
C.8,736 lít. D. 1,792 lít.
Hướng dẫn giải
Đáp án B
Ta có nAl = 3,24 : 27 = 0,12 mol
Al + NaOH + H2O NaAlO2 + H2
= = 0,18 mol
→ = 0,18.22,4 = 4,032 lít
Câu 13:Nhôm bền trong môi trường nước và không khí là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit Al2O3 bền vững bảo vệ.
C. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. nhôm có tính thụ động với không khí và nước.
Hướng dẫn giải
Đáp án B
Nhôm là kim loại hoạt động mạnh.Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước, kể cả khi đun nóng.
Câu 14:Để khử hoàn toàn mgam hỗn hợp CuO và PbO cần 8,1g kim loại nhôm, sau phản ứng thu được 50,2g hỗn hợp 2 kim loại. Giá trị của m là
A. 53,4g B. 57,4g C. 54,4g D. 56,4g
Hướng dẫn giải
Đáp án B
nAl = 8,1 : 27 = 0,3 mol
Áp dụng định luật bảo toàn khối lượng:
→ m + 8,1 = 0,15.102 + 50,2
→ m = 57,4 gam
Câu 15: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M. B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M. D. 0,35M hoặc 0,55M.
Hướng dẫn giải
Đáp án D
= 0,03
Bảo toàn electron: 3.nAl = 2.
→ nAl = 0,02 → mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→ =
→ bđ = 0,03 mol
Bảo toàn nguyên tố Al → = nAl + 2. bđ = 0,08 mol
thu được = 3,57 : 102 = 0,035 mol
= 0,07 mol
Trường hợp 1: NaAlO2 + HCl + H2O Al(OH)3 + NaCl
nHCl = = 0,07 mol
→ CM HCl = = 0,35M
Trường hợp 2:
→ nHCl = 0,11 mol
→ CM HCl = = 0,55M
Câu 16: Trong công nghiệp, Al được sản xuất từ quặng boxit
A. bằng phương pháp điện phân nóng chảy.
B. bằng phương pháp nhiệt luyện .
C. bằng phương pháp thủy luyện.
D. Trong lò cao.
Hướng dẫn giải
Đáp án A
Trong công nghiệp, Al được sản xuất từ quặng boxit bằng phương pháp điện phân nóng chảy.
2Al2O3 4Al + 3O2
Câu 17: Oxi hóa hoàn toàn 8,1 gam nhôm cần vừa đủ V lít khí clo (đktc). Giá trị của V là
A. 7,84. B. 10,08. C. 6,72. D. 11,2.
Hướng dẫn giải
Đáp án B
2Al + 3Cl2 2AlCl3
Xem thêm các phương trình hóa học hay khác:
- 4Al + 3O2 → 2Al2O3
- 2Al + 3S → Al2S3
- Al + Cl2 → AlCl3
- 2Al + 6HCl → 2AlCl3 + 3H2
- 2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2
- 2Al + 6H2SO4(đặc) → Al2(SO4)3 + 3SO2 ↑ + 6H2O.
- 8Al + 30HNO3(loãng) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
- Al + 6HNO3(đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
- 2Al + Fe2O3 → Al2O3 + 2Fe
- 2Al + 6H2O → 2Al(OH)3 ↓ + 3H2 ↑
- Phản ứng hóa học:2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- 2Al + 3Br2 → 2AlBr3
- 2Al + 3I2 → 2AlI3
- 2Al + 3F2 → 2AlF3
- 4Al + 3C → Al4C3
- 2Al + 2NH3 → 2AlN + 3H2 ↑
- 4Al + 3CO2 → 2Al2O3 + 3C
- 2Al + 3CuO → Al2O3 + 3Cu
- 2Al + 3CuCl2 → 2AlCl3 + 3Cu
- 2Al + 3Cu(NO3)2 → 3Cu + 2Al(NO3)3
- 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
- 2Al + 3FeO → Al2O3 + 3Fe
- 8Al + 3Fe3O4 → 4Al2O3 + 9Fe
- 2Al + 3FeCl2 → 2AlCl3 + 3Fe
- Al + 3FeCl3 → AlCl3 + 3FeCl2
- Al + FeCl3 → AlCl3 + Fe
- 2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
- Al + Fe2(SO4)3 → Al2(SO4)3 + FeSO4
- 2Al + 3Fe(NO3)2 → 3Fe + Al(NO3)3
- Al + 3Fe(NO3)3 → 3Fe(NO3)2 + Al(NO3)3
- 2Al + Cr2O3 → Al2O3 + 2Cr
- 2Al + Cr2(SO4)3 → Al2(SO4)3 + 2Cr
- 2Al + 3PbO → Al2O3 + 3Pb
- 2Al + 3SnO → Al2O3 + 3Sn
- 8Al + 3Mn3O4 → 4Al2O3 + 9Mn
- Al + 3AgNO3 → 3Ag + Al(NO3)3
- 2Al + 3ZnSO4 → Al2(SO4)3 + 3Zn
- 2Al + 3Pb(NO3)2 → 2Al(NO3)3 + 3Pb
- 4Al + 3SiO2 → 2Al2O3 + 3Si
- 2Al + 3CaO → Al2O3 + 3Ca
- 10Al + 6NH4ClO4 → 5Al2O3 + 9H2O + 6HCl + 3N2 ↑
- 8Al + 3KClO4 → 4Al2O3 + 3KCl
- 2Al + 4H2SO4 → Al2(SO4)3 + 4H2O + S ↓
- 8Al + 15H2SO4 → 4Al2(SO4)3 + 12H2O + 3H2S ↑
- 8Al + 27HNO3 → 9H2O + 3NH3 ↑ + 8Al(NO3)3
- Al + 4HNO3 → 2H2O + NO ↑ + Al(NO3)3
- 2Al + 6HF → 3H2 ↑ + 2AlF3
- 2Al + 3H2S → Al2S3 + 3H2 ↑
- 2Al + 6CH3COOH → 2(CH3COO)3Al + 3H2 ↑
- 2Al + 2H3PO4 → 3H2 ↑ + 2AlPO4
- 2Al + 6HBr → 3H2 ↑ + 2AlBr3
- 4Al + K2Cr2O7 → Al2O3 + 2Cr + 2KAlO2
- 8Al + 21H2SO4 + 3K2Cr2O7 → 4Al2(SO4)3 + 21H2O + 3K2SO4 + 6CrSO4
- 2Al + 3H2O → Al2O3 + 3H2 ↑
- Al + 6KNO3 → 2Al2O3 + 3N2 ↑ + 6KAlO2
- 8Al + 2H2O + 3NaNO3 + 5NaOH → 3NH3 ↑ + 8NaAlO2
- 8Al + 18H2O + 3KNO3 + 5KOH → 3NH3 ↑ + 8KAl(OH)4
- 2Al + 4BaO → 3Ba + Ba(AlO2)2
- 2Al + 4CaO → 3Ca + Ca(AlO2)2
- Al + Ca(OH)2 + H2O → H2 ↑ + Ca(AlO2)2
- 2Al + 2H2O + Ba(OH)2 → 3H2 ↑ + Ba(AlO2)2
- 2Al + 2H2O + 2KOH → 3H2 ↑ + 2KAlO2
- 2Al + 2H2O + 2NaOH → 3H2 ↑ + 2NaAlO2
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



