Ma trận đề thi Giữa kì 1 Hóa học 10 năm 2024
Tài liệu Ma trận đề thi Giữa kì 1 Hóa học 10 năm 2024 mới nhất gồm bảng đặc tả và 3 đề thi có đáp án và lời giải chi tiết. Hi vọng Ma trận đề thi Giữa kì 1 Hóa học 10 năm 2024 sẽ giúp học sinh có kế hoạch ôn tập, luyện đề hiệu quả từ đó đạt kết quả cao trong các bài thi môn Hóa học lớp 10.
Ma trận đề thi Giữa kì 1 Hóa học 10 năm 2024
MA TRẬN ĐỀ THI GIỮA HỌC KÌ 1
MÔN: Hóa học 10 – THỜI GIAN LÀM BÀI: 45 phút
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ nhận thức |
Tổng |
% tổng Điểm |
|
|||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
|
|||||||||||
|
Số CH |
Thời gian (phút) |
|
|||||||||||||
|
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
TN |
TL |
|
|||||
|
1 |
Chương Nguyên tử |
Thành phần cấu tạo nguyên tử |
2 |
1,5 |
1 |
1 |
1 |
4,5 |
1 |
6 |
3 |
1 hoặc 2 |
22,5 |
50% |
|
|
Hạt nhân nguyên tử, nguyên tố hóa học, đồng vị. |
1 |
0,75 |
1 |
1 |
2 |
|
|||||||||
|
Cấu tạo vỏ nguyên tử |
2 |
1,5 |
2 |
2 |
|
|
4 |
1 hoặc 0 |
|
||||||
|
Cấu hình electron nguyên tử |
3 |
2,25 |
2 |
2 |
|
|
5 |
|
|||||||
|
2
|
Chương Bảng tuần hoàn |
Bảng tuần hoàn các nguyên tố hóa học |
2 |
1,5 |
2 |
2 |
1
|
4,5
|
1
|
6
|
4 |
2
|
22,5
|
50%
|
|
|
Sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất hóa học của các nguyên tố. Định luật tuần hoàn. |
5 |
3,75 |
2 |
2 |
7 |
|
|||||||||
|
Ý nghĩa bảng tuần hoàn các nguyên tố hóa học |
1 |
0,75 |
2 |
1 |
2 |
|
|||||||||
|
Tổng |
16 |
12 |
12 |
12 |
2 |
9 |
2 |
12 |
28 |
4 |
45 |
|
|
||
|
Tỉ lệ % |
40% |
30% |
20% |
10% |
|
|
|
|
|
||||||
|
Tỉ lệ chung |
70% |
30% |
|
|
|
|
|||||||||
Lưu ý:
- Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng.
- Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm. Số điểm của câu tự luận được quy định trong hưỡng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận.
- Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng, trong đó 1 câu ở đơn vị kiến thức thành phần cấu tạo nguyên tử hoặc hạt nhân nguyên tử, nguyên tố hóa học, đồng vị hoặc cấu tạo vỏ nguyên tử hoặc cấu hình electron nguyên tử và 1 câu ở đơn vị kiến thức bảng tuần hoàn các nguyên tố hóa học hoặc sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất hóa học của các nguyên tố, định luật tuần hoàn hoặc ý nghĩa bảng tuần hoàn các nguyên tố hóa học.
- Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng cao, trong đó 1 câu ở đơn vị kiến thức thành phần cấu tạo nguyên tử hoặc hạt nhân nguyên tử, nguyên tố hóa học, đồng vị và 1 câu ở đơn vị kiến thức bảng tuần hoàn các nguyên tố hóa học hoặc sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất hóa học của các nguyên tố, định luật tuần hoàn hoặc ý nghĩa bảng tuần hoàn các nguyên tố hóa học.
- Không được chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
Đề thi Giữa học kì 1 năm học 2021
Môn thi Hóa học - Lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
PHẦN TRẮC NGHIỆM
Câu 1: Kí hiệu của electron là
A. e.
B. n.
C. p.
D. q.
Câu 2: Hạt nhân của hầu hết các nguyên tử đều tạo bởi hạt nào sau đây?
A. Electron và neutron.
B. Electron và proton.
C. neutron và proton.
D. neutron, proton và electron.
Câu 3: Nguyên tử nguyên tố F có 9 proton, 9 electron và 10 neutron. Điện tích hạt nhân nguyên tử F là bao nhiêu?
A. 9+.
B. 9-.
C. 10+.
D. 10-.
Câu 4: Phân lớp p có tối đa bao nhiêu electron?
A. 2 electron.
B. 6 electtron.
C. 10 electron.
D. 14 electron.
Câu 5: Trong nguyên tử, electron chuyển động rất nhanh trong khu vực không gian xung quanh hạt nhân và
A. theo quỹ đạo tròn.
B. theo quỹ đạo bầu dục.
C. theo những quỹ đạo xác định.
D. không theo những quỹ đạo xác định.
Câu 6: Cấu hình electron của nguyên tử Al là 1s22s22p63s23p1. Lớp thứ hai (lớp L) của nguyên tử Al có bao nhiêu electron?
A. 2.
B. 8.
C. 3.
D. 1.
Câu 7: Nguyên tử X có 7 electron lớp ngoài cùng. X là nguyên tử của nguyên tố
A. phi kim.
B. kim loại.
C. khí hiếm.
D. hiđro.
Câu 8: Mức năng lượng của phân lớp nào sau đây thấp nhất?
A. 1s.
B. 2s.
C. 2p.
D. 3s.
Câu 9: Trong bảng tuần hoàn, có bao nhiêu chu kì nhỏ?
A. 4.
B. 3.
C. 2.
D. 1.
Câu 10: Trong bảng tuần hoàn, các nguyên tố có cùng số lớp electron trong nguyên tử được xếp
A. cùng một hàng.
B. cùng một cột.
C. cùng một ô.
D. thành hai cột.
Câu 11: Các nguyên tố thuộc cùng một nhóm A có
A. cùng số electron trong nguyên tử.
B. số electron ở lớp ngoài cùng bằng nhau.
C. số lớp electron trong nguyên tử bằng nhau.
D. cùng nguyên tử khối.
Câu 12: Theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố trong nhóm IA thay đổi như thế nào?
A. Tăng dần.
B. Giảm dần.
C. Không thay đổi.
D. Vừa tăng vừa giảm.
Câu 13: Trong nhóm IIA, theo chiều tăng của điện tích hạt nhân, tính bazơ của các hidroxit tương ứng với nguyên tố biến đổi như thế nào?
A. Mạnh dần.
B. Yếu dần.
C. Không biến đổi.
D. Biến đổi không quy luật.
Câu 14: Theo chiều tăng của điện tích hạt nhân, số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong chu kì 2 biến đổi như thế nào?
A. Tăng dần.
B. Giảm dần.
C. Không thay đổi.
D. Không theo quy luật.
Câu 15: Hóa trị trong oxit cao nhất của nguyên tố nhóm IIA là bao nhiêu?
A. 2.
B. 4.
C. 3.
D. 1.
Câu 16: Trong nguyên tử của các nguyên tố nhóm IA có bao nhiêu electron lớp ngoài cùng?
A. 2.
B. 7.
C. 8.
D. 1.
Câu 17: Kích thước của nguyên tử chủ yếu là
A. kích thước của hạt proton.
B. kích thước của hạt electron.
C. kích thước của lớp vỏ.
D. kích thước của hạt nhân.
Câu 18: Nguyên tử nguyên tố P có 15 proton, 16 neutron, 15 electron được kí hiệu là
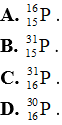
Câu 19: Đồng là hỗn hợp của hai đồng vị bền 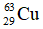 chiếm 73% và
chiếm 73% và 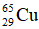 chiếm 27% tổng số nguyên tử đồng trong tự nhiên. Nguyên tử khối trung bình của đồng là bao nhiêu?
chiếm 27% tổng số nguyên tử đồng trong tự nhiên. Nguyên tử khối trung bình của đồng là bao nhiêu?
A. 63,54.
B. 64,46.
C. 64,54.
D. 63,46.
Câu 20: Nguyên tử O (Z = 8) có bao nhiêu lớp electron?
A. 1 lớp.
B. 2 lớp.
C. 3 lớp.
D. 4 lớp.
Câu 21: Cấu hình electron nguyên tử Al là 1s22s22p63s23p1. Số electron lớp ngoài cùng của nguyên tử Al là bao nhiêu?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 22: Cấu hình electron của nguyên tử Mg là 1s22s22p63s2. Mg thuộc loại nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f.
Câu 23: Cho cấu hình electron nguyên tử các nguyên tố: Li (1s22s1), Mg (1s22s22p63s2), C (1s22s22p2). Nguyên tố nào cùng thuộc chu kì 2?
A. Li, Mg, C.
B. Li, Mg.
C. Li, C.
D. Mg, C.
Câu 24: Cấu hình electron nguyên tử X là 1s22s22p6. Nguyên tố X ở vị trí nào trong bảng tuần hoàn ?
A. Chu kì 3, nhóm VIA.
B. Chu kì 3, nhóm VIIIA
C. Chu kì 2 nhóm VIA.
D. Chu kì 2, nhóm VIIIA.
Câu 25: Cho các nguyên tố Na (Z =11), Mg (Z = 12), Al ( Z = 13) thuộc chu kì 3 trong bảng tuần hoàn. Dãy các nguyên tố được xếp theo chiều tăng dần tính kim loại là
A. Na, Mg, Al.
B. Mg, Al, Na.
C. Al, Mg, Na.
D. Al, Na, Mg.
Câu 26: Các nguyên tố halogen được xếp theo chiều tăng dần của điện tích hạt nhân: F, Cl, Br, I. Nguyên tố halogen nào có tính phi kim mạnh nhất?
A. F.
B. Cl.
C. Br.
D. I.
Câu 27: Trong bảng tuần hoàn, nguyên tố X ở chu kì 2, nhóm VA. Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là
A. 2s22p3.
B. 2s22p5.
C. 2s22p1.
D. 2s22p6.
Câu 28: Nguyên tố R thuộc nhóm VIIA, công hợp chất khí của R với hidro là
A. RH.
B. RH2.
C. RH3.
D. RH4.
PHẦN TỰ LUẬN
Câu 29 (1 điểm): Cho: Li (Z = 3); Cl ( Z = 17).
a) Viết cấu hình electron nguyên tử của nguyên tố Li, Cl.
b) Hãy cho biết Li, Cl là nguyên tố s, p hay d? Giải thích.
Câu 30 (1 điểm): Nguyên tố X thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn.
a) Viết cấu hình electron nguyên tử X.
b) Nguyên tố X là kim loại, phi kim hay khí hiếm? Giải thích.
Câu 31 (0,5 điểm): Hiđro có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị trong 1 ml nước?
Biết: Trong nước chỉ có hai đồng vị 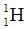 và
và 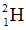 ; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxi bằng 16; số Avogadro N = 6,02.1023.
; khối lượng riêng của nước là 1 g/ml; nguyên tử khối của oxi bằng 16; số Avogadro N = 6,02.1023.
Câu 32 (0,5 điểm): Cho hai nguyên tố: Y (Z = 12); M (Z =19). So sánh tính chất hóa học (tính kim loại hoặc tính phi kim) của Y và M. Giải thích. Cho Na ( Z = 11).
Xem thêm tài liệu ma trận đề thi môn Hóa học lớp 10 chọn lọc, có đáp án hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

