Ma trận đề thi Giữa kì 2 Hóa học 10 năm 2024
Tài liệu Ma trận đề thi Giữa kì 2 Hóa học 10 năm 2024 mới nhất gồm bảng đặc tả và 3 đề thi có đáp án và lời giải chi tiết. Hi vọng Ma trận đề thi Giữa kì 2 Hóa học 10 năm 2024 sẽ giúp học sinh có kế hoạch ôn tập, luyện đề hiệu quả từ đó đạt kết quả cao trong các bài thi môn Hóa học lớp 10.
Ma trận đề thi Giữa kì 2 Hóa học 10 năm 2024
MA TRẬN ĐỀ THI GIỮA HỌC KÌ 2
MÔN: Hóa học 10 – THỜI GIAN LÀM BÀI: 45 phút
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ nhận thức |
Tổng |
% tổng Điểm |
|||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
|
||||||||||
|
Số CH |
Thời gian (phút) |
|
||||||||||||
|
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
Số CH |
Thời gian (phút) |
TN |
TL |
|||||
|
1 |
Halogen và hợp chất |
Khái quát về nhóm halogen |
2 |
1,5 |
1 |
1 |
1 |
4,5 |
|
|
3 |
2 hoặc 1 |
13 hoặc 18 |
27,5% Hoặc 32,5 |
|
Các đơn chất halogen |
4 |
3,0 |
3 |
3 |
1 |
6,0 |
7 |
|||||||
|
Hidro halogenua. Axit halogenhiđric. Muối halogenua. |
3 |
2,25 |
3 |
3 |
1 |
4,5 |
6 |
32 hoặc 27 |
72,5% hoặc 67,5% |
|||||
|
Hợp chất chứa oxi của clo |
2 |
1,5 |
2 |
2 |
4 |
2 hoặc 3 |
||||||||
|
Thực hành |
1 |
0,75 |
1 |
1 |
|
|
2 |
|||||||
|
2 |
Oxi - ozon |
Oxi – ozon |
4 |
3,0 |
2 |
2 |
1 |
6,0 |
6 |
|||||
|
Tổng |
16 |
12 |
12 |
12 |
2 |
9 |
2 |
12 |
28 |
4 |
45 |
|
||
|
Tỉ lệ % |
40% |
30% |
20% |
10% |
|
|
|
|
||||||
|
Tỉ lệ chung |
70% |
30% |
|
|
|
|||||||||
Lưu ý:
- Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng.
- Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm. Số điểm của câu tự luận được quy định trong hưỡng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận.
- Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng, trong đó 1 câu ở đơn vị kiến thức khái quát nhóm halogen hoặc đơn chất halogen và 1 câu ở đơn vị kiến thức hidro halogenua, axit halogenhiđric, muối halogenua hoặc hợp chất chứa oxi của clo hoặc thực hành hoặc oxi, ozon.
- Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng cao, trong đó 1 câu ở đơn vị kiến thức đơn chất halogen hoặc hidro halogenua, axit halogenhiđric, muối halogenua hoặc hợp chất chứa oxi của clo và 1 câu ở đơn vị kiến oxi, ozon.
- Không được chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
Đề thi Giữa học kì 2 năm học 2021
Môn thi Hóa học - Lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
PHẦN TRẮC NGHIỆM
Câu 1: Trong bảng tuần hoàn, các nguyên tố halogen thuộc nhóm nào?
A.VIA.
B.VIIA.
C. VA.
D. IVA.
Câu 2: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm halogen có dạng
A. ns2np5.
B. ns2np4.
C. ns2np3.
D. ns2np6.
Câu 3: Trong phòng thí nghiệm, khí clo có thể được điều chế bằng cách cho hydrochloric acid đặc tác dụng với chất rắn nào sau đây?
A. CaCl2.
B. KMnO4.
C. NaCl.
D. MnCl2.
Câu 4: Ở nhiệt độ thường, chất nào sau đây là chất lỏng màu đỏ nâu?
A. F2.
B. Br2.
C. I2.
D. Cl2.
Câu 5 : Chất nào đây được dùng để diệt trùng nước sinh hoạt?
A. Clo.
B. Brom.
C. Oxi.
D. Nitơ.
Câu 6: Trong công nghiệp, người ta sản xuất iot từ nguyên liệu nào sau đây?
A. Muối sodium chloride.
B. Rong biển.
C. Tinh bột.
D. Đá vôi.
Câu 7: Chất nào sau đây tác dụng được với dung dịch HCl?
A. NaNO3.
B. Cu.
C. Ag.
D. NaOH.
Câu 8: Ở nhiệt độ thường, hiđro clorua
A. tan rất nhiều trong nước.
B. tan rất ít trong nước.
C. không tan trong nước.
D. tan ít trong nước.
Câu 9: Thuốc thử thường dùng để nhận biết ion clorua là
A. silver nitrate.
B. quỳ tím.
C. brom.
D. tinh bột.
Câu 10: Công thức hóa học của clorua vôi là
A. CaCl2.
B. CaOCl2.
C. Ca(OH)2.
D. CaO.
Câu 11: Trong phòng thí nghiệm, nước Gia- ven được điều chế bằng cách cho khí clo tác dụng với dung dịch loãng chứa chất nào sau đây ở nhiệt độ thường?
A. KCl.
B. NaOH.
C. Ca(OH)2.
D. Ba(OH)2.
Câu 12: Trong phòng thí nghiệm, điều chế hiđro clorua bằng cách cho H2SO4 đặc vào ống nghiệm chứa chất rắn X rồi đun nóng. Chất X là
A. NaCl.
B. NaOH.
B. Cu.
D. Cu(OH)2.
Câu 13: Trong bảng tuần hoàn, nguyên tố oxi thuộc nhóm VIA. Số electron lớp ngoài cùng của nguyên tử oxi là
A. 6.
B. 7.
C. 5.
D. 4.
Câu 14: Trong phòng thí nghiệm, oxi được chế bằng cách phân hủy chất nào sau đây?
A. KMnO4.
B. CaCO3.
C. Fe(OH)3.
D. Cu(OH)2.
Câu 15: Ở điều kiện thường, so với oxi thì ozon có
A. tính oxi hóa mạnh hơn.
B. tính oxi hóa yếu hơn.
C. phân tử khối nhỏ hơn.
D. tính oxi hóa bằng nhau.
Câu 16: Ozon là một dạng thù hình của chất nào sau đây?
A. Oxi.
B. Clo.
C. Cacbon.
B. Flo.
Câu 17: Dãy các chất: Flo, clo, brom, iot, có tính oxi hóa giảm dần là do
A. nguyên tử đều có 7 electron.
B. phân tử đều có hai nguyên tử.
C. có nguyên tử khối tăng dần.
D. có độ âm điện giảm dần.
Câu 18: Iot tác dụng với hồ tinh bột tạo thành hợp chất có màu
A. đỏ.
B. vàng.
C. xanh.
D. trắng.
Câu 19: Chất nào sau đây chỉ có tính oxi hóa?
A. F2.
B. Br2.
C. Cl2.
D. I2.
Câu 20: Ở nhiệt độ thường, 0,2 mol Cl2 tác dụng được tối đa với x mol NaOH trong dung dịch. Giá trị của x là
A. 0,1.
B. 0,2.
C. 0,3.
D. 0,4.
Câu 21: Cho dung dịch chứa 0,2 mol HCl tác dụng hết với Fe dư, thu được V lít H2 (đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 1,12.
D. 3,36.
Câu 22: Dung dịch chất nào sau đây ăn mòn thủy tinh?
A. NaCl.
B. HCl.
C. NaF.
D. HF.
Câu 23: Axit HCl tác dụng với CuO tạo ra sản phẩm gồm những chất nào sau đây?
A. CuCl2, H2O.
B. CuCl2, H2.
C. Cu, H2O.
D. Cu, H2.
Câu 24: Số oxi hóa của clo trong phân tử NaClO là
A. -1.
B. +3.
C. +1.
D. +5.
Câu 25: Clorua vôi được dùng để tẩy trắng vải, sợi, giấy là do clorua vôi có tính
A. oxi hóa mạnh.
B. oxi hóa yếu.
C. khử mạnh.
D. khử yếu.
Câu 26: Chỉ dùng chất nào sau đây phân biệt được hai dung dịch riêng biệt: NaCl, HCl?
A. AgNO3.
B. Quỳ tím.
C. Cu.
D. K2SO4.
Câu 27: Trong phòng thí nghiệm, khí oxi được thu bằng phương pháp dời chỗ của nước. Phương pháp này dựa vào tính chất nào sau đây của oxi?
A. Tan tốt trong nước.
B. Ít tan trong nước.
C. Tính oxi hóa mạnh.
D. Nặng hơn không khí.
Câu 28: Ở nhiệt độ thường, O3 tác dụng với Ag tạo ra sản phẩm
A. chỉ có Ag2O.
B. Ag2O và O2.
C. Ag2O2 và O2.
D. AgO và O2.
PHẦN TỰ LUẬN :
Câu 29 (1 điểm): Viết phương trình hóa học của các phản ứng theo sơ đồ sau:
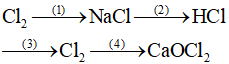
Câu 30 (1 điểm): Cho m gam KMnO4 tác dụng hết với dung dịch HCl (đặc) dư, toàn bộ khí clo sinh ra tác dụng hết với Fe dư, thu được 16,25 gam FeCl3. Tính số mol HCl phản ứng và giá trị m.
Câu 31 (0,5 điểm): Để mẩu giấy quỳ tím ẩm vào bình khí clo một thời gian. Nêu hiện tượng và giải thích.
Câu 32 (0,5 điểm): Nung m gam cacbon trong bình kín chứa V lít oxi (đktc). Sau khi cacbon phản ứng hết, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 18. Dẫn toàn bộ X qua dung dịch Ca(OH)2 dư thu được 20 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính V.
Xem thêm tài liệu ma trận đề thi môn Hóa học lớp 10 chọn lọc, có đáp án hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

