Bài toán xác định tên kim loại Cr, Fe, Cu (hay, chi tiết)
Bài viết Bài toán xác định tên kim loại Cr, Fe, Cu với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Bài toán xác định tên kim loại Cr, Fe, Cu.
Bài toán xác định tên kim loại Cr, Fe, Cu (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập tổng hợp về sắt và hợp chất của sắt - Cô Nguyễn Thị Thu (Giáo viên VietJack)
1. Phương pháp
Tính trực tiếp khối lượng mol của kim loại. Nếu đề bài không cho hóa trị của kim loại thì ta thiết lập một phương trình thể hiện mối quan hệ giữa hóa trị và M rồi biện luận.
Lưu ý: Thường sử dụng các phương pháp như: Định luật bảo toàn khối lượng, định luật bảo toàn electron … để tìm kim loại
2. Ví dụ minh họa
Ví dụ 1: Cho 19,2 gam một kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất NO (đktc). Kim loại M là kim loại nào sau đây:
A. Mg B. Cu
C. Fe D. Zn
Lời giải:
Chọn đáp án: C
Giải thích:
Số mol NO là nNO = 4,48/22,4 = 0,2 mol
3M + 4nHNO3 → 3M(NO3)n + nNO + 2nH2O
0,6/n 0,2 mol
M = 19,2/(0,6/n) = 32n → n = 2; M = 64 → M: Cu
Ví dụ 2: Dẫn luồng khí CO dư qua ống đựng 0,03 mol oxit sắt, khí sau phản ứng cho vào dung dịch Ca(OH)2 dư thu được 12 g kết tủa. Vậy công thức của oxit sắt là:
A. Fe3O4
B. FeO
C. Fe2O3
D. Fe3O4 hoặc FeO
Lời giải:
Chọn đáp án: A
Giải thích:
Ta có: nCaCO3 = 12/100 = 0,12 mol
Xét sơ đồ sau:
FexOy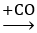
0,03 0,03y 0,03y
Ta có: 0,03y = 0,12 → y =4
3. Bài tập vận dụng
Câu 1: Khi hòa tan hiđroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối trung hòa có nồng độ 27,21%. Kim loại M là:
A. Fe B. Zn
C. Cu D. Mg
Lời giải:
Chọn đáp án: C
Giải thích:
Giả sử đem 1 mol H2SO4 phản ứng, ta có:
mdung dich H2SO4 = 1.98/20 .100=490 (gam)
mdung dịch sau phản ứng = 490 + (M + 34) (gam)
M(OH)2 + H2SO4 → MSO4 + 2H2O
(mol) 1 1 1
Theo đề bài ta có: (M+96)/(490+(M+34)) = 0,2721 => M≈64: đồng
Câu 2: Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dung dịch H2SO4 đặc nóng (dư), thu được 20,16 (lít) khí SO2 (sản phẩm khử duy nhất, ở đktc). Oxit MxOy là:
A. Cr2O3
B. FeO
C. Fe3O4
D. CrO
Lời giải:
Chọn đáp án: C
Giải thích:
Ta có: nCO = 0,8 mol; nSO2 = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron. H2SO4 đặc là chất oxi hóa nhận electron:
M - ne → M+n
1,8/n 1,8
S+6 + 2e → SO2+4
1,8 0,9
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
n0 (trong oxit) = nCO = 0,8 mol
Tỉ lệ: x/y = nM/nO = (1,8/n)/0,8 = 9/4n
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3.
+ Nếu n = 2 ⇒ x/y = 9/8 (loại vì không có đáp án phù hợp)
+ Nếu n = 3 ⇒ x/y = 3/4
=> CT oxit là Fe3O4
Câu 3: Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là kim loại nào?
A. Zn B. Fe
C. Al D. Ni
Lời giải:
Chọn đáp án: B
Giải thích:
Khối lượng kim loại phản ứng là
mKL = (1,68%. 50)/100% = 0,84(g)
Số mol H2 là nH2 = 0,336/22,4 = 0,015 (mol)
M + nHCl → MCln + nH2
Số mol của M là nM = 2/n. nH2 = 2. 0,015/n = 0,03/n (mol)
M = 0,84/(0,03/n) = 28n => M = 28n => n = 2, M = 56 => M: Fe
Câu 4: Khử 4,8 gam một oxit kim loại trong dãy điện hóa ở nhiệt độ cao, cần 2,016 lít H2. Kim loại thu được đem hòa tan trong dung dịch HCl, thu được 1,344 lít H2. Biết các khí đo ở đktc. Vậy oxit cần tìm là:
A. FeO
B. Fe2O3
C. CuO
D. Ag2O
Lời giải:
Chọn đáp án: B
Giải thích:
MxOy + yH2 →t o xM + yH2O
a ay ax
M + nHCl → MCln + n/2H2↑
ax axn/2
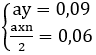
Ta có: (Mx + 16y)a = 4,8 → Max + 16ay = 4,8 (1)
Thay ay = 0,09 và ax = 0,12/n vào (1)
Ta có: M = 28n → n = 2 → M = 56 : Fe
Thay n = 2 vào ta có: ax = 0,06
ax/ay = 0,06/0,09 ⇒ x/y = 2/3 → Fe2O3
Câu 5: Khi cho cùng một lượng kim loại M tác dụng với dung dịch HCl và H2SO4 đặc nóng thì khối lượng SO2 sinh ra gấp 48 lần H2 sinh ra. Mặt khác, khối lượng muối clorua bằng 31,75% khối lượng muối sunfat. Vậy M là:
A. Fe B. Cu
C. Al D. Mg
Lời giải:
Chọn đáp án: A
Giải thích:
M + nHCl → MCln + n/2H2↑
1 n/2 mol
2M + 2mH2SO4 đ,n → M2(SO4)m + mSO2 + 2mH2O
1 m/2 mol
Ta có: khối lượng SO2 = m/2. 64 = 32m (g)
Khối lượng H2 = n/2. 2 = n (g)
Theo đề ra: 32m = 48n → m/n = 3/2
Vậy M có 2 hóa trị là 2 và 3.
Mặt khác: (M+35,5. 2)/(2M + 96. 3) = 31,75/100 → M = 56
Vậy M là Fe
Câu 6: Hòa tan hoàn toàn m (g) một oxit sắt bằng H2SO4 đặc nóng thu được a mol SO2 (duy nhất). Mặt khác, sau khi khử hoàn toàn m (g) oxit trên bằng H2 ở nhiệt độ cao rồi cho toàn bộ lượng sắt tạo thành vào H2SO4 đặc nóng dư thì thu được 9a mol SO2 (duy nhất). Vậy oxit sắt là:
A. FeO
B. Fe2O3
C. Fe3O4
D. FeO hoặc Fe2O3.
Lời giải:
Chọn đáp án: C
Giải thích:
2FexOy + (6x-2y)H2SO4 (đ,n) → xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
2a/(3x-2y) ← a mol
FexOy + yCO → xFe + yCO2
2a/(3x-2y) 2ax/(3x-2y) mol
2Fe + 6H2SO4 (đ,n) → Fe2(SO4)3 + 3SO2 + 6H2O
2ax/(3x-2y) 3ax/(3x-2y) mol
Ta có: 2ax/(3x-2y) = 9a → x/y = 3/4 → Fe3O4
Câu 7: Khử hoàn toàn 16g oxit của kim loại M có hóa trị III người ta dùng đủ 6,72 lít khí CO (đktc) thu được kim loại M và khí CO2. Xác định tên M và CTHH của oxit trên?
Lời giải:
Giải thích:
Gọi CTHH của oxit là M2O3
PTHH: M2O3 + 3CO → 2M + CO2
nCO = 0,3 mol
Theo PT ta thấy: nM2O3 = 1/3. nCO = 0,1 mol
=>MM2O3 = 16/0,1 = 160 (g/mol)
=> 2M + 16.3 = 160 => M = 56 (Fe)
Vậy kim loại M là Fe và CTHH của oxit là Fe2O3
Bài giảng: Bài tập sắt, hợp chất của sắt tác dụng với chất oxi hóa mạnh - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Bài toán hỗn hợp kim loại tác dụng với axit
- Hợp chất sắt tác dụng với axit
- Bài tập về tính oxi hóa của muối Sắt 3 III
- Bài tập về muối của kim loại chuyển tiếp Fe, Cu, Ag, Zn
- Bài tập crom tác dụng với axit
- Bài tập về tính khử của hợp chất crom 2 (II)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

