Các dạng bài tập Pin điện và điện phân lớp 12 (Chuyên đề dạy thêm Hóa 12)
Tài liệu Các dạng bài tập Pin điện và điện phân lớp 12 trong Chuyên đề dạy thêm Hóa học 12 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa 12.
Các dạng bài tập Pin điện và điện phân lớp 12 (Chuyên đề dạy thêm Hóa 12)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Chỉ từ 300k mua trọn bộ Chuyên đề dạy thêm Hóa học 12 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Dạng 1: Bài toán về sức điện động
|
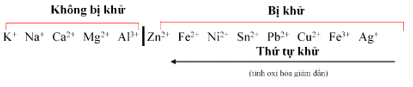
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI ♦ Thế điện cực chuẩn của một số cặp oxi hóa – khử:
- Giá trị trên có thể sai khác do tham khảo các nguồn tài liệu khác nhau. Nếu đề bài cho giá trị thế điện cực chuẩn thì sử dụng giá trị cho ở đề bài. ♦ Sức điện động của pin điện hóa: |
* Ví dụ minh họa
Câu 1. [KNTT - SGK] Cho pin điện hóa tạo bởi hai cặp oxi hóa – khử ở điều kiện chuẩn: Pb2+/Pb và Zn2+/Zn với thế điện cực chuẩn tương ứng là -0,126V và -0,762V.
(a) Xác định anode, cathode của pin điện.
(b) Viết quá trình xảy ra ở mỗi điện cực và phương trình hóa học của phản ứng xảy ra khi pin hoạt động.
(c) Xác định sức điện động chuẩn của pin.
Câu 2. [CD - SGK] Sử dụng bảng thế điện cực chuẩn, xác định sức điện động của pin Galvani tạo bởi các cặp oxi hoá khử sau, đồng thời chỉ ra điện cực dương, điện cực âm của pin trong mỗi trường hợp sau:
(a) Ni2+/Ni và Ag+/Ag
(b) Zn2+/Zn và 2H+/H2
Câu 3. Cho biết thế điện cực chuẩn của cặp = -0,763V và sức điện động chuẩn của pin Zn – X bằng 1,103 V. Hãy xác định thế điện cực chuẩn của cặp X2+/X biết rằng trong pin Zn – X thì Zn đóng vai trò làm anode.
Câu 4. [KNTT - SGK] Sức điện động chuẩn của pin điện hóa gồm hai điện cực M2+/M và Ag+/Ag bằng 1,056V. Trong số các kim loại Cu, Fe, Ni, Sn:
(a) Hãy cho biết kim loại nào phù hợp với M.
(b) Lựa chọn kim loại M để pin điện hóa có sức điện động chuẩn lớn nhất.
Cho biết:
|
Cặp oxi hóa – khử |
Fe2+/Fe |
Ni2+/Ni |
Sn2+/Sn |
Cu2+/Cu |
Ag+/Ag |
|
Thế điện cực chuẩn (V) |
-0,44 |
-0,257 |
-0,137 |
+0,340 |
+0,799 |
Câu 5. [KNTT - SBT] Cho các pin điện hoá và sức điện động chuẩn tương ứng:
|
Pin điện hóa |
Cu - X |
Y - Cu |
Z - Cu |
|
Sức điện động chuẩn (V) |
0,46 |
1,1 |
1,47 |
(X, Y, Z là ba kim loại)
Dãy các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là:
A. X, Cu, Z, Y.
B. Y, Z, Cu, X
C. Z, Y, Cu, X
D. X, Cu, Y, Z.
* Bài tập tự luyện
1. Trắc nghiệm nhiều lựa chọn
Câu 6. [CD - SGK] Cho: = -0,763 V; = -0,257 V. Sức điện động chuẩn của pin Zn - Ni là
A. -0,506 V.
B. 0,506 V.
C. 0,465 V.
D. -0,465 V.
Câu 7. [CD - SGK] Cho: = -0,138 V; = 0,340 V. Sức điện động chuẩn của pin Sn – Cu là
A. 478 V
B. 0,334 V.
C. 0,478 V.
D. 334 V.
Câu 8. Cho: = 0,34 V; = 0,80 V; = -2,37 V; = -0,76 V. So sánh sức điện động của pin điện hóa Cu - Ag và Mg – Zn nào sau đây là đúng?
A.
B.
C.
D.
Câu 9. [KNTT - SBT] Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
|
Cặp oxi hoá-khử |
Cu2+/Cu |
Zn2+/Zn |
Fe2+/Fe |
Ag+/Ag |
|
Thế điện cực chuẩn (V) |
+0,34 |
-0,762 |
-0,44 |
+0,799 |
Pin có sức điện động lớn nhất là
A. Pin Zn -Cu.
B. Pin Fe-Cu.
C. Pin Cu-Ag.
D. Pin Fe-Ag.
Câu 10. [KNTT - SBT] Sức điện động chuẩn của pin điện hoá H2–Cu (gồm hai điện cực ứng với hai cặp oxihoá – khử là 2H+/H2 và Cu2+/Cu) đo được bằng vôn kế có điện trở vô cùng lớn là 0,340V. Từ đó, xác định được thế điện cực chuẩn của cặp Cu2+/ Cu là:
A. -0,340V.
B. 0,000V
C. 0,680 V.
D. +0,340 V.
2. Trắc nghiệm trả lời ngắn
Câu 11. [KNTT - SBT] Một pin điện hoá được thiết lập từ hai điện cực tạo bởi hai cặp oxi hoá - khử là M2+/M và Ag+/Ag. Cho biết:
|
Cặp oxi hoá - khử |
Fe2+/Fe |
Ni2+/Ni |
Sn2+/Sn |
Cu2+/Cu |
Ag+/Ag |
|
Thế điện cực chuẩn (V) |
-0,44 |
-0,257 |
-0,137 |
+0,340 |
+0,799 |
Nếu M là một trong số các kim loại: Fe, Ni, Sn, Cu thì sức điện động chuẩn lớn nhất của pin bằng bao nhiêu vôn? Kết quả làm tròn đến hàng phần trăm.
Câu 12. [KNTT - SBT] Cho các pin điện hoá và sức điện động chuẩn tương ứng:
|
Pin điện hóa |
Ni- Sn |
Zn-Cu |
Sn -Cu |
|
Sức điện động chuẩn (V) |
0,12 |
1,101 |
0,597 |
Sức điện động chuẩn của pin Ni - Zn bằng bao nhiêu V? (Làm tròn kết quả đến phần trăm.)
Câu 13. [KNTT - SBT] Hai cặp oxi hoá - khử Ni2+/Ni và Cd2+/Cd tạo thành pin có sức điện động chuẩn là 0,146 V. Phản ứng xảy ra trong pin: Cd + Ni2+⟶Cd2+ + Ni, Thế điện cực chuẩn của cặp Cd2+/Cd có giá trị là bao nhiêu vôn? Làm tròn kết quả đấn hàng phần mười. (Cho biết: ở trạng thái chuẩn, pin Ni - Pb có sức điện động 0,131 V; E0Pb2+/Pb = -0,126V
Dạng 2: Bài toán điện phân
|
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI 1. Lý thuyết về điện phân ♦ Điện phân nóng chảy - Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước. - Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước. ♦ Điện phân dung dịch - Nguyên tắc khử ở cathode: Chất oxi hóa mạnh hơn bị khử trước. - Nguyên tắc oxi hóa ở anode: Chất khử mạnh hơn bị oxi hóa trước. + Các anion chứa oxygen như SO42-, CO32-, NO3-, PO43-, ClO4- và F- coi như không bị điện phân. + Các ion còn lại điện phân theo thứ tự: I- → Br- → Cl- → H2O - Quá trình oxi hóa và khử H2O:
♦ Điện lượng: Trong đó: Q là điện lượng (C) , n là số mol electron đi qua dây dẫn, I là cường độ dòng điện A, t là thời gian (giây), F là hằng số Faraday (96500 C.mol-1). 2. Phương pháp giải bài tập điện phân - Sử dụng định luật bảo toàn e: - mdd giảm = mkim loại + mkhí. - mcathode tăng = mkim loại sinh ra. - Khi điện phân dung dịch hỗn hợp nhiều chất thì viết quá trình điện phân tại các điện cực theo thứ tự và dựa vào giữ kiện đề bài như mol e trao đổi, mdd giảm, mcathode tăng, bắt đầu thoát khí, … để xác định xem phản ứng dừng lại ở đâu. - Khi điện phân tại các thời điểm khác nhau thì thời gian tỉ lệ thuận với mol e trao đổi: |
* Ví dụ minh họa
Câu 1. [KNTT - SBT] Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu và ở anode có V mL khí O2 (25oC, 1 bar) bay ra. Giá trị của V là
A. 495,8
B. 124,0
C. 247,9
D. 743,7.
Câu 2. Điện phân lượng dư dung dịch CuSO4 trong thời gian 193 phút bằng dòng điện 2,5A. Cho biết các công thức: , trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện A, t là thời gian (giây), F là hằng số Faraday 96500C.mol-1.
Khối lượng Cu và O2 thu được ở mỗi điện cực lần lượt là
A. 9,6 gam và 2,4 gam.
B. 9,6 gam và 3,2 gam.
C. 19,2 gam và 9,6 gam.
D. 19,2 gam và 3,2 gam.
Câu 3. [CD - SBT] Điện phân dung dịch NaCl có màng ngăn với cường độ dòng điện 10A trong 2 giờ. Tính khối lượng dung dịch giảm sau khi điện phân, giả thiết chỉ có phản ứng điện phân dung dịch NaCl, bỏ qua lượng nước bay hơi. Cho biết các công thức:
trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện A, t là thời gian (giây), F là hằng số Faraday 96500C.mol-1..
Câu 4. (A.10): Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Thể tích khí (đkc) thoát ra ở anode sau 9650 giây điện phân là
A. 1,2395 lít.
B. 2,479 lít.
C. 1,9832 lít.
D. 4,958 lít.
Câu 5. (B.12): Điện phân dung dịch hỗn hợp gồm 0,1 mol FeCl3, 0,2 mol CuCl2 và 0,1 mol HCl (điện cực trơ). Khi ở cathode bắt đầu thoát khí thì ở anode thu được V lít khí (đkc). Biết hiệu suất của quá trình điện phân là 100%. Giá trị của V là
A. 6,1975.
B. 12,395.
C. 24,79.
D. 4,958.
Câu 6. Điện phân (điện cực trơ, có màng ngăn) 2 lít dung dịch gồm CuSO4 và 0,01 mol NaCl đến khi cả 2 điện cực đều thoát ra 495,8 mL khí (đkc) thì ngừng điện phân. Giả sử nước bay hơi không đáng kể trong quá trình điện phân. Giá trị pH dung dịch sau điện phân là
A. 1,4.
B. 1,7.
C. 1,2.
D. 2,0.
Câu 7. (A.11): Hoà tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t giây, được y gam kim loại M duy nhất ở cathode và 0,035 mol khí ở anode. Còn nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là
A. 4,788.
B. 4,480.
C. 1,680.
D. 3,920.
Câu 8. Trong công nghiệp, người ta tích hợp quá trình sản xuất xút (sodium hydroxide) với khí chlorine bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Một nhà máy với quy mô sản xuất 300 tấn xút mỗi ngày thì cần bao nhiêu m3 nước biển? Biết rằng nước biển có khối lượng riêng là 1030 kg/m3, C% của NaCl trong loại nước biển này là 3,5% và hiệu suất của toàn bộ quá trình đạt 80%.
Câu 9. [CD - SBT] Một loại quặng nhôm có chứa 40% khối lượng Al.
(a) Nhôm trong loại quặng trên ở dạng Al2O3, hỏi quặng trên chứa bao nhiêu phần trăm tạp chất.
(b) Để điện phân toàn bộ lượng Al2O3 nóng chảy thu được từ 1000 kg loại quặng trên bởi dòng điện một chiều có cường độ 10000 A thì về lí thuyết cần bao nhiêu giờ điện phân liên tục? Cho biết số mol electron n đi qua dây dẫn được tính theo công thức n = (I.t)/F.
Trong đó, I là cường độ dòng điện (A), t là thời gian (s), F là số Faraday (96500C.mol-1).
Câu 10. [CD - SGK] Xét quá trình sản xuất nhôm được thực hiện theo phương pháp điện phân Al2O3 nóng chảy với điện cực than chì.
(a) Giải thích vì sao thực tế thành phần thể tích khí bay ra ở cực dương gồm CO (30% - 50%) và CO2 (70% - 50%) mà không phải là O2.
(b) Trung bình để sản xuất được 1 tấn Al thì lượng điện cực than chì bị tiêu hao do phản ứng oxi hoá là bao nhiêu? Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích.
Câu 11. (B.13) Điện phân nóng chảy Al2O3 với các điện cực bằng than chì, thu được m kilogam Al ở cathode và 99,16 m3(đkc) hỗn hợp khí X ở anode. Tỉ khối của X so với H2 bằng 16,7. Cho 1,2395 lít X (đkc) phản ứng với dung dịch Ca(OH)2 dư, thu được 1,5 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 144,0.
B. 104,4.
C. 82,8.
D. 115,2.
Câu 12. [CD - SBT] Cần mạ một lớp Ag lên một mặt của một chiếc đĩa tròn có bán kính 12 cm. Với độ dày lớp mạ là 0,01 mm, nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2 A trong thời gian t = 3 giờ thì có đủ để mạ theo yêu cầu trên không? Biết rằng khối lượng riêng của Ag là 10,5 g cm-3, hiệu suất điện phân là 100%.
Câu 13. Muốn mạ đồng một tấm sắt có diện tích tổng cộng 200 cm2, người ta dùng tấm sắt làm cathode của một bình điện phân đựng dung dịch CuSO4 và anode là một thanh đồng nguyên chất, rồi cho dòng điện có cường độ I = 10 A chạy qua trong thời gian 2 giờ 40 phút 50 giây. Tìm bề dày lớp đồng bám trên mặt tấm sắt (mm). Cho biết đồng có khối lượng riêng D = 8,9.103 kg/m3.
* Bài tập tự luyện
1. Trắc nghiệm nhiều lựa chọn
Câu 14. [KNTT - SBT] Điện phân 500 mL dung dịch CuSO4 0,2 M (điện cực trơ) cho đến khi ở cathode thu được 3,2 g kim loại thì thể tích khí (đkc) thu được ở anode là
A. 1,24 lít.
B. 2,48 lít.
C. 0,62 lít.
D. 3,72 lít.
Câu 15. [KNTT - SBT] Điện phân dung dịch M(NO3)n (điện cực trơ, cường độ dòng điện không đổi), ở cathode chỉ thu được 5,4 g kim loại M và ở anode thu được 0,31 lít khí (đkc). Kim loại M là
A. Fe.
B. Cu.
C. Ag.
D. Pb.
................................
................................
................................
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 12 các chủ đề hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

