Ôn tập chương Pin điện và điện phân lớp 12 (Chuyên đề dạy thêm Hóa 12)
Tài liệu Ôn tập chương Pin điện và điện phân lớp 12 trong Chuyên đề dạy thêm Hóa học 12 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa 12.
Ôn tập chương Pin điện và điện phân lớp 12 (Chuyên đề dạy thêm Hóa 12)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Chỉ từ 300k mua trọn bộ Chuyên đề dạy thêm Hóa học 12 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
|
CẶP OXI HÓA – KHỬ CỦA KIM LOẠI |
|
- Dạng oxi hóa (Mn+) và dạng khử (M) của cùng một kim loại tạo nên cặp oxi hóa – khử, giữa chúng có mối quan hệ: Mn+ + ne M |
|
THẾ ĐIỆN CỰC CHUẨN |
|
♦ Khái niệm: Thế điện cực chuẩn là đại lượng đánh giá khả năng khử giữa các dạng khử và khả năng oxi hóa giữa các dạng oxi hóa ở điều kiện chuẩn. ♦ Ý nghĩa - Giá trị thế điện cực chuẩn của cặp oxi hóa – khử Mn+/M càng lớn thì tính oxi hóa của ion Mn+ càng mạnh và tính khử của kim loại M càng yếu và ngược lại. - Phản ứng hóa học giữa hai cặp oxi hóa – khử xảy ra theo chiều: Chất oxi hóa của cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn oxi hóa chất khử của cặp oxi hóa - khử có thế điện cực chuẩn nhỏ hơn. |
|
NGUỒN ĐIỆN HÓA HỌC |
|
♦ Pin Galvani - Pin Galvani có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hóa – khử và thường nối với nhau qua cầu muối. - Ở anode xảy ra quá trình oxi hóa còn ở cathode xảy ra quá trình khử. - Sức điện động chuẩn của pin: ♦ Một số nguồn điện khác - Acquy thuộc loại pin sạc, được sử dụng phổ biến trong nhiều loại ô tô. - Pin nhiên liệu và pin Mặt Trời là những năng lượng sạch, tiềm năng. |
|
ĐIỆN PHÂN |
|
♦ Thứ tự điện phân - Tại anode, chất khử mạnh hơn bị oxi hóa trước. - Tại cathode, chất oxi hóa mạnh hơn bị khử trước. ♦ Ứng dụng - Nhôm được sản xuất bằng phương pháp điện phân nóng chảy: 2Al2O3 4Al + 3O2 - Đồng được tinh luyện bằng phương ppháp điện phân với anode bằng đồng thô. - Mạ điện được sử dụng để trang trí bề mặt hoặc bảo vệ kim loại khỏi sự ăn mòn. |
* Bài tập tự luyện
1. Trắc nghiệm nhiều lựa chọn
Câu 1. [KNTT - SBT] Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng lớn thì dạng khử có tính khử...(1)... và dạng oxi hoá có tính oxi hoá...(2)... Cụm từ cần điền vào (1) và (2) lần lượt là
A. càng mạnh và càng yếu.
B. càng mạnh và càng mạnh.
C. càng yếu và càng yếu.
D. càng yếu và càng mạnh.
Câu 2. [KNTT - SBT] Cặp oxi hoá - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ hơn 0?
A. Ag+/Ag.
B. Na+/Na.
C. Hg2+/Hg.
D. Cu2+/Cu
Câu 3. [KNTT - SBT] Kí hiệu cặp oxi hoá - khử tương ứng với quá trình khử:
Fe(OH)3 + le → Fe(OH)2 + OH- là
A. Fe3+/Fe2+.
B. Fe2+/Fe.
C. Fe3+/Fe.
D. Fe(OH)3/Fe(OH)2.
Câu 4. [KNTT - SBT] Trong dãy điện hoá của kim loại, khi đi từ trái sang phải, tính oxi hoá của cảc ion kim loại biến đổi như thế nào?
A. Không đổi.
B. Tuần hoàn.
C. Giảm dần.
D. Tăng dần.
Câu 5. [CTST - SBT] Dãy kim loại sắp xếp theo chiều tăng dần tính khử từ trái sang phải là
A. Pb, Ni, Sn, Zn.
B. Pb, Sn, Ni, Zn.
C. Ni, Sn, Zn, Pb.
D. Ni, Zn, Pb, Sn.
Câu 6. [CTST - SBT] Dãy cation kim loại được sắp xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
A. Cu2+. Fe2+, Mg2+.
B. Mg2+, Fe2+, Cu2+.
C. Mg2+, Cu2+ Fe2+.
D. Cu2+, Mg2+, Fe2+.
Câu 7. [KNTT - SGK] Xét các cặp oxi hóa – khử sau:
|
Cặp oxi hóa – khử |
Al3+/Al |
Ag+/Ag |
Mg2+/Mg |
Fe2+/Fe |
|
Thế điện cực chuẩn (V) |
-1,676 |
+0,799 |
-2,356 |
-0,44 |
(a) Kim loại có tính khử mạnh nhất, yếu nhất lần lượt là
A. Mg, Ag.
B. Al, Ag.
C. Al, Fe.
D. Mg, Fe.
(b) Số kim loại khử được ion H+ thành khí H2 ở điều chuẩn là
A. 1.
B. 2.
C. 3.
D. 4.
(c) Số kim loại khử được ion Ag+ thành Ag ở điều kiện chuẩn là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 8. [CTST - SBT] Dung dịch chất nào sau đây có thể hòa tan được lá sắt?
A. AlCl3.
B. Fe2(SO4)3
C. FeCl2.
D. MgCl2
Câu 9. [KNTT - SBT] Cho thứ tự sắp xếp các cặp oxi hoá - khử trong dãy điện hoá: Mg2+/Mg; H2O/H2, OH-; 2H+/H2; Ag+/Ag. Thí nghiệm nào sau đây không xảy ra phản ứng ở điều kiện chuẩn?
A. Cho sợi phoi bào Mg vào nước.
B. Cho lá Mg vào dung dịch HC1.
C. Cho lá Ag vào dung dịch H2SO4.
D. Cho sợi Mg vào dung dịch AgNO3.
Câu 10. [KNTT - SBT] Xét phản ứng hoá học giữa hai cặp oxi hoá - khử của kim loại:
R + 2M+ → R2+ + 2M
Biết giá trị thế điện cực chuẩn các cặp oxi hoá - khử M+/M và R2+/R lần lượt là X (V) và y (V). Nhận xét nào sau đây đúng?
A. x < y.
B. x > y.
C. x - y.
D. 2x = y.
Câu 11. [KNTT - SBT] Cho phản ứng hoá học: Cu + 2Fe3+ → Cu2+ + 2Fe2+.
Phát biểu nào sau đây về phản ứng trên không đúng?
A. Cu bị Fe3+ oxi hoá thành Cu2+.
B. Cu2+ có tính oxi hoá mạnh hơn Fe3+.
C. Fe3+ bị Cu khử thành Fe2+.
D. Cu là chất khử, Fe3+ là chất oxi hoá.
Câu 12. [KNTT - SBT] Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
|
Cặp oxi hóa – khử |
Na+/Na |
Mg2+/Mg |
Al3+/A1 |
Cu2+/Cu |
|
Thể điện cực chuẩn (V) |
-2,713 |
-2,356 |
-1,676 |
+0,340 |
lon kim loại nào sau đây bị khử tại cathode khi điện phân (với điện graphite) dung dịch muối sulfate tương ứng?
A. Mg2+.
B. Na+.
C. Cu2+.
D. Al3+.
Câu 13. [KNTT - SBT] Trong pin điện hoá Zn - Cu, ở anode (cực âm) xảy ra quá trình
A. oxi hoá Zn thành ion Zn2+.
B. khử ion Cu2+ thành Cu.
C. khử Cu thành ion Cu2+.
D. oxi hoá ion Zn2+ thành Zn.
Câu 14. [CTST - SBT] Phát biểu nào sau đây không đúng về pin Galvani?
A. Ở điện cực dương xảy ra quá trình oxi hóa.
B. Cathode là kim loại yếu hơn, đóng vai trò điện cực dương của pin.
C. Anode là kim loại mạnh hơn, đóng vai trò điện cực âm của pin.
D. Phản ứng hóa học diễn ra trong pin kèm theo sự giải phóng điện năng.
Câu 15. [CTST - SBT] Cho pin điện hóa Mn-Cd có (Mn-Cd) = 0,79 V và = -0,40 V. Thế điện cực chuẩn của cặp oxi hóa khử Mn2+/Mn có giá trị là
A. 0,27 V.
B. -0,39 V.
C. 0,26 V.
D. -0,25 V.
Câu 16. [CTST - SBT] Quá trình điện phân dung dịch NaCl (điện cực trơ, có màng ngăn) và điện phân NaCl nóng chảy (điện cực trơ) có điểm giống nhau là
A. tại cathode xảy ra sự khử ion Na+.
B. tại cathode xảy ra sự khử phân tử H2O.
C. tại anode xảy ra sự oxi hóa ion Cl-.
D. tại anode xảy ra sự oxi hóa phân tử H2O.
Câu 17. [KNTT - SBT] Khi điện phân dung dịch NaCl bằng dòng điện một chiều (với điện cực trơ, có màng ngăn xốp) thì ở cathode xảy ra quá trình
A. oxi hoá H2O thành H+ và O2.
B. khử Cl- thành Cl2.
C. oxi hoá Cl- thành Cl2.
D. khử H2O thành H2 và OH-.
Câu 18. [KNTT - SBT] Khi điện phân dung dịch CuSO4 bằng dòng điện một chiều (với điện cực anode bằng Cu) thì ở anode xảy ra quá trình
A. oxi hoá H2O thành H+ và O2.
B. khử Cu2+ thành Cu.
C. oxi hoá Cu thành Cu2+.
D. khử H2O thành H2 và OH-.
Câu 19. [CTST - SBT] Điện phân một dung dịch gồm: HCl, CuCl2, NaCl với điện cực trơ, có màng ngăn. Kết luận nào sau đây không đúng?
A. Sau khi kết thúc quá trình điện phân, pH của dung dịch tăng so với dung dịch ban đầu.
B. Các chất bị điện phân lần lượt theo thứ tự: CuCl2, HCl, NaCl và H2O.
C. Các quá trình điện phân NaCl làm tăng pH của dung dịch.
D. Quá trình điện phân HCl làm giảm pH của dung dịch.
Câu 20. [CTST - SBT] Dung dịch X chứa hỗn hợp các muối: NaCl, CuCl2, FeCl3 và ZnCl2. Kim loại cuối cùng thu được ở cathode, sau khi điện phân hoàn toàn dung dịch X là
A. Na.
B. Cu.
C. Fe.
D. Zn.
Câu 21. [CTST - SBT] Cho 4 dung dịch chứa các ion sau:
|
Dung dịch |
Ion |
|
(1) |
Cu2+, Ag+, NO3- |
|
(2) |
Na+, K+, Br-, Cl- |
|
(3) |
Na+, K+, Cl-, OH- |
|
(4) |
Cu2+, Zn2+, SO42- |
Lần lượt điện phân các dung dịch trên với điện cực trơ. Dung dịch nào sau khi điện phân có môi trường acid?
A. (1), (2).
B. (1), (4).
C. (1), (3).
D. (2), (3).
2. Trắc nghiệm đúng - sai
Câu 22. [KNTT - SBT] Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y
Cho biết:
|
Cặp oxi hoá - khử |
Fe2+/Fe |
Cu2+/Cu |
Fe3+/Fe2+ |
|
Thế điện cực chuẩn (V) |
-0,44 |
+0,340 |
+0,771 |
a. X gồm hai kim loại.
b. Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
c. Y gồm hai chất tan là CuSO4 và FeSO4
d. Trong điều kiện Fe2(SO4)3 dư thì Y gồm ba muối.
Câu 23. [CTST - SBT] Cách để tạo thành một pin điện hóa:
a. Một điện cực nhôm và một điện cực đồng cùng nhúng vào dung dịch nước muối.
b. Một điện cực nhôm và một điện cực đồng cùng nhúng vào nước cất.
c. Hai điện cực làm bằng đồng cùng nhúng vào dung dịch nước vôi trong.
d. Hai điện cực làm bằng nhựa nhúng vào dầu hỏa.
Câu 24. [CTST - SBT] Pin điện hóa là một thiết bị có khả năng tạo ra năng lượng điện cho các phản ứng hóa học.
a. Trong pin điện hóa, anode là cực dương, cathode là nơi xảy ra sự oxi hóa.
b. Trong bình điện phân, anode là cực dương, nơi xảy ra quá trình khử.
c. Trong pin điện hóa và bình điện phân, anode là nơi xảy ra quá trình oxi hóa, cathode là nơi xảy ra quá trình khử.
d. Các điện cực trong pin điện hóa và bình điện phân khác nhau về bản chất, giống nhau về dấu.
Câu 25. [CTST - SBT] Một pin điện hóa có điện cực kẽm nhúng trong dung dịch ZnSO4 và điện cực đồng nhúng trong dung dịch CuSO4. Xét biến thiên khối lượng của điện cực sau một thời gian pin đó phóng điện.
a. Cả hai điện cực kẽm và đồng đều giảm.
b. Điện cực kẽm tăng còn khối lượng điện cực đồng giảm.
c. Điện cực kẽm giảm còn khối lượng điện cực đồng tăng.
d. Cả hai điện cực kẽm và đồng đều tăng.
Câu 26. [KNTT - SBT] Cho các phát biểu về thế điện cực và pin điện hóa:
a. Kim loại càng mạnh thì thế điện cực chuẩn càng âm.
b. Khi tạo thành pin điện hoá, kim loại mạnh hơn sẽ đóng vai trò là cathode.
c. Điện phân dung dịch CuSO4, cứ thu được 1 mol Cu thì khối lượng dung dịch giảm 80 g.
d. Để bảo vệ đồ vật bằng kim loại, nên gắn chúng với những mảnh kim loại yếu hơn.
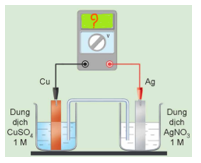
Câu 27. [KNTT - SBT] Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ bên. Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V vả +0,799 V.
a. Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
b. Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử Ag+.
c. Điện cực Cu tăng khối lượng, điện cực Ag giảm khối lượng.
d. Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+→ Cu2+ + 2Ag.
Câu 28. [CTST - SBT] Hiện tượng điện phân có nhiều ứng dụng trong thực tiễn sản xuất và đời sống như luyện kim, tinh chế kim loại, mạ điện, …
a. Trong quá trình điện phân dung dịch, khối lượng dung dịch luôn giảm.
b. Trong quá trình điện phân dung dịch, ở cathode luôn xảy ra quá trình khử.
c. Trong quá trình điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), pH của dung dịch tăng.
d. Trong quá trình điện phân dung dịch, cathode luôn thu được kim loại.
Câu 29. [CTST - SBT] Thực hiện thí nghiệm điện phân dung dịch CuSO4 với các điện cực trơ.
a. Ở cathode xảy ra quá trình oxi hóa Cu2+.
b. Nước bị điện phân ở anode, sinh ra khí O2.
c. Sau quá trình điện phân, pH của dung dịch giảm.
d. Trong quá trình điện phân, màu xanh của dung dịch nhạt dần.
3. Trắc nghiệm trả lời ngắn
Câu 30. [CTST - SBT] Cho dung dịch FeCl2 tác dụng với dung dịch AgNO3 dư. Sau phản ứng có bao nhiêu chất kết tủa được sinh ra?
Câu 31. [CTST - SBT] Cho pin điện hóa Al-Cu. Biết = -1,66 V và = 0,34 V. Sức điện động chuẩn của pin điện hóa Al – Cu bằng bao nhiêu V?
Câu 32. [CTST - SBT] Cho = 3,17 V và = -2,37 V. Tính thế điện cực chuẩn của cặp oxi hóa-khử Ag+/Ag (). Kết quả làm tròn đến hàng phần mười.
Câu 33. [KNTT - SBT] Một pin Galvani được lắp ghép từ hai điện cực tạo bởi hai cặp oxi hoá - khử là Pb2+/Pb (Epb2+/pb = - 0,126 v) và Fe3+/Fe2+ (EFe3+/Fe2+ = +0,771 V). Sức điện động chuẩn của pin Galvani trên là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Câu 34. [KNTT - SBT] Sức điện động chuẩn của một pin Galvani (được lắp ghép từ hai điện cực tạo bởi hai cặp oxi hoá - khử là 2H+/H2 và Ag+/Ag) đo được bằng vôn kế có điện trở vô cùng lớn là 0,771 V. Từ kết quả trên, xác định được thế điện cực chuẩn của cặp Ag+/Ag là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Câu 35. [KNTT - SBT] Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu?
................................
................................
................................
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 12 các chủ đề hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

