Phương pháp đồ thị trong hóa học (chi tiết, có lời giải)
Bài viết Phương pháp đồ thị trong hóa học với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phương pháp đồ thị trong hóa học.
Phương pháp đồ thị trong hóa học (chi tiết, có lời giải)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Phương pháp giải
Các dạng bài sử dụng khảo sát đồ thị:
+ Bài toán cho CO2 (SO2) tác dụng với dung dịch Ca(OH)2 hoặc Ba(OH)2
Phương trình:
CO2 + 2OH- → CO32- + H2O
Khi CO2 dư tiếp tục xảy ra phản ứng
CO2 + CO32- → HCO3-
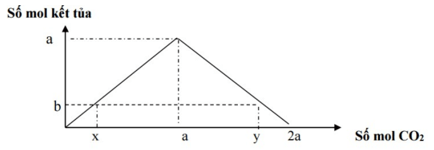
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại, sau đó tan dần đến hết
- n↓ cực đại = a = nCO2
- Nếu 0 < n↓ < a ⇒ Có 2 giá trị của CO2
TH1: CO2 thiếu tạo kết tủa chưa cực đại: nCO2 = a
TH2: CO2 dư tạo kết tủa cực đại sau đó hòa tan kết tủa:
nCO2 = 2a – n ↓= nOH- - n ↓
+ Bài toán liên quan tới muối Al3+ tác dụng với OH-
Phương trình:
Al3+ + 3OH- → Al(OH)3
Nếu OH- dư tiếp tục xảy ra phản ứng:
Al(OH)3 + OH- → AlO2- + 2H2O
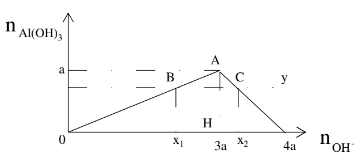
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại sau đó tan dần đến hết
- n↓cực đại = a khi đó nOH- = 3a
- Nếu 0 < n↓ < a thì có 2 trường hợp của OH-
TH1: n↓ tạo ra chưa cực đại nOH- = 3n↓;
TH2: n↓ đạt cực đại sau đó lại tan khi đó nOH- = 4a – n↓
+ Muối AlO2- tác dụng với dung dịch H+
Phương trình:
AlO2- + H+ + H2O → Al(OH)3
Khi H+ dư tiếp tục xảy ra phản ứng:
Al(OH)3 + 3H+ → Al3+ + 3H2O
- Hiện tượng: Xuất hiện kết tủa tăng dần đến cực đại, sau đó tan cho đến hết
- n↓cực đại = a khi đó nH+ = a
- 0 < n ↓ < a khi đó có 2 trường hợp:
TH1: Kết tủa chưa đạt cực đại: n↓ = nH+
TH2: Kết tủa đạt cực đại sau đó bị H+ hòa tan: nH+ = 4a – 3n↓
Ví dụ minh họa
Ví dụ 1: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình
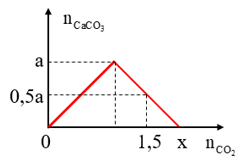
Giá trị của x là:
A. 1,8 mol.
B. 2,2 mol.
C. 2,0 mol.
D. 2,5 mol.
Giải:
Dựa theo đồ thị xác định được: Khi nCO2 = 1,5 kết tủa đã đạt cực đại và bị hòa tan
⇒ nCO2 = 1,5 = 2n↓ cực đại – n↓ = 2a – 0,5a = 1,5a
⇒ a = 1
Khi nCO2 = x kết tủa đã bị hòa tan hết ⇒ nCO2 = 2n ↓ cực đại = 2a = 2
⇒ Đáp án C
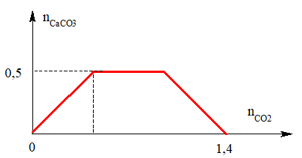
Ví dụ 2: Khi sục từ từ đến dư CO2 vào dung dịch hỗn hợp gồm a mol Ca(OH)2 và b mol NaOH, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
A. 4 : 5.
B. 5 : 4.
C. 2 : 3.
D. 4 : 3.
Giải:
Dựa theo đồ thị ta có:
Khi kết tủa đạt cực đại nCaCO3 = nCa(OH)2 = a = 0,5 mol
Khi nCO2 = 1,4 khi đó CO32- bị hòa tan hết
⇒ nCO2 = nOH- = 2a + b = 1,4
⇒ b = 0,4
⇒ a : b = 0,5 : 0,4 = 5 : 4
⇒ Đáp án B.
Ví dụ 3: Trong 1 bình kín chứa 0,2 mol Ba(OH)2. Sục vào bình lượng CO2 có giá trị biến thiên trong khoảng từ 0,05 mol đến 0,24 mol thu được m gam kết tủa. Giá trị của m biến thiên trong khoảng nào sau đây?
A. 0 đến 39,4 gam.
B. 0 đến 9,85 gam.
C. 9,85 đến 39,4 gam.
D. 9,85 đến 31,52 gam.
Giải:
n↓ cực đại = nBa2+ = 0,2 mol; Khi kết tủa hòa tan hết nCO2 = nOH- = 0,4
Ta có: 0,05 < n↓ cực đại = 0,2 < 0,24 < 0,4
Ta có đồ thị:
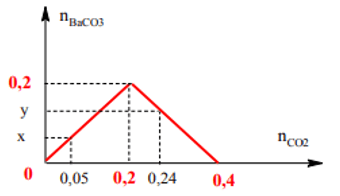
Từ đồ thị: Khi nCO2 = 0,05 mol kết tủa chưa đạt cực đại
⇒ x =n↓ = nCO2 = 0,05 mol ⇒ m↓ = 9,85g
Khi nCO2 = 0,24 kết tủa đạt cực đại và hòa tan một phần
⇒ y = n↓ = 2n↓ cực đại – nCO2 = 0,4 – 0,24 = 0,16mol ⇒ m↓ = 39,4g
Vậy kết tủa phải biến thiên trong khoảng 9,85 gam đến cực đại là 39,4 gam.
⇒ Đáp án C
Ví dụ 4: Sục từ từ 0,6 mol CO2 vào V lít dung dịch chứa Ba(OH)2 0,5M thu được 2x mol kết tủa. Mặt khác khi sục 0,8 mol CO2 cũng vào V lít dung dịch chứa Ba(OH)2 0,5M thì thu được x mol kết tủa. Giá trị của V, x lần lượt là:
A. V = 1,0 lít; x = 0,2 mol.
B. V = 1,2 lít; x = 0,3 mol.
C. V = 1,5 lít; x = 0,5 mol.
D. V = 1,0 lít; x = 0,4 mol.
Giải:
Dễ thấy số mol CO2 tăng từ 0,6 → 0,8 thì lượng kết tủa giảm ⇒ ứng với 0,8 mol CO2 sẽ có pư hòa tan kết tủa.
nkết tủa cực đại = nBa2+ = 0,5V
TH1: Với nCO2 = 0,6 mol kết tủa chưa bị hòa tan. Đồ thị như sau:
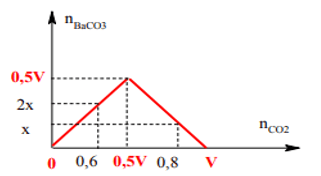
Từ đồ thị suy ra:
Khi nCO2 = 0,6 mol ⇒ nCO2 = n↓ ⇒ 2x = 0,6
⇒ x = 0,3
Khi nCO2 = 0,8 kết tủa đã bị hòa tan một phần:
nCO2 = 2. 0,5V – 2x ⇒ x = V – 0,8
⇒ V = 1,1 lít (loại không có đáp án)
TH2: nCO2 = 0,6 mol kết tủa đã hòa tan. Đồ thị như sau:
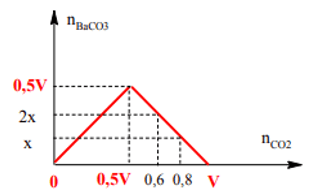
Từ đồ thị: ⇒
⇒ V = 1,0 và x = 0,2 ⇒ Đáp án A
Ví dụ 5: Dẫn từ từ 4,928 lít CO2 ở đktc vào bình đựng 500 ml dung dịch X gồm Ca(OH)2 xM và NaOH yM thu được 20 gam kết tủa. Mặt khác cũng dẫn 8,96 lít CO2 đktc vào 500 ml dung dịch X trên thì thu được 10 gam kết tủa. Tính x, y ?
A. 0,2 và 0,4.
B. 0,4 và 0,2.
C. 0,2 và 0,2.
D. 0,4 và 0,4.
Giải :
Ta có : Với nCO2 = 0,22 mol thì n↓ = 0,2 < nCO2
⇒ Với nCO2 = 0,22 mol thì kết tủa đã bị hoà tan
Với nCO2 = 0,4 mol thì n↓ = 0,1
nOH⁻ = x + 0,5y ; nCa²⁺= 0,5x
⇒ n↓max = 0,5x.
Đồ thị :
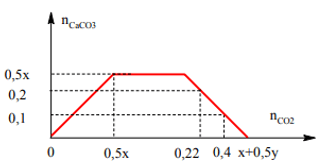
Từ đồ thị:
+ Nếu tạo ra 20g kết tủa Ba2+ vẫn còn dư ( 0,5x >0,2)
Ta có hệ: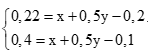
⇒ Khi tạo 20g kết tủa ion Ba2+ đã kết tủa hết với ion CO32-
0,5x = 0,2 ⇒ x = 0,4
Ta có 20g là kết tủa cực đại ⇒ khi kết tủa 10g là kết tủa hòa tan 1 phần:
0,4 = x + 0,5y – 0,1 ⇒ y = 0,2 mol
⇒ Đáp án B
Ví dụ 6: Cho 800 ml dung dịch KOH x mol/l phản ứng với 500 ml dung dịch Al2(SO4)3 0,4M đến pư hoàn toàn thu được 11,7 gam kết tủa. Gía trị của x là:
A. 0,5625
B. 1,8125
C. 0,15
D. Cả A và B
Giải:
Số mol Al3+ = 0,4 mol⇒ n↓ max = 0,4 mol > n↓ = 11,7 : 78 = 0,15 mol
Ta xây dựng được đồ thị
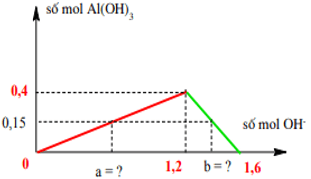
Từ đồ thị ⇒ a = 3nAl(OH)3 = 0,15. 3 = 0,45 mol
4nAl3+ - n↓= nOH- ⇒ 1,6 – 0,15 = b ⇒ b = 1,45 mol
⇒ x = 0,45 : 0,8 = 0,5625 lít hoặc x = 1,45 : 0,8 = 1,8125 lít.
⇒ Đáp án D
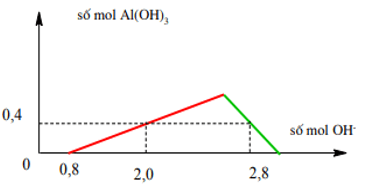
Ví dụ 7: Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hh gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
A. 4 : 3.
B. 2 : 1.
C. 1 : 1.
D. 2 : 3.
Giải
Từ đồ thị ⇒ Khi bắt đầu có kết tủa thì HCl đã bị trung hòa hết
nHCl = a = 0,8 mol
Khi nOH- = 2,8 kết tủa bị hòa tan một phần
ta có: nOH- = nH+ + 4nAl3+ - n↓ = a + 4b – 0,4 = 2,8 ⇒ b = 0,6 mol
⇒a : b = 4 : 3 ⇒ Đáp án A
Ví dụ 8: Cho từ từ V ml dung dịch NaOH 1M vào 200 ml dung dịch gồm HCl 0,5M và Al2(SO4)3 0,25M. Đồ thị biểu diễn khối lượng kết tủa theo V như hình dưới. Giá trị của a, b tương ứng là:
A. 0,1 và 400.
B. 0,05 và 400.
C. 0,2 và 400.
D. 0,1 và 300.
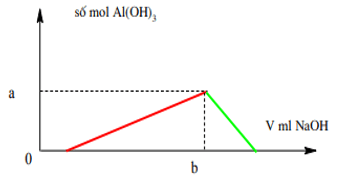
Giải:
Ta có nH+ = 0,1 mol; nAl3+ = 0,1 mol.
Vì kết tủa cực đại bằng số mol Al3+ = 0,1 mol ⇒ a = 0,1 mol.
Từ đồ thì ta cũng có:
Khi kết tủa cực đại nOH- = b= nH+ + 3nAl3+ = 0,1 + 3.0,1 = 0,4 mol
⇒ b = 0,4 : 1 = 0,4 lít = 400 ml
⇒ Đáp án A
Ví dụ 9: Hoà tan vừa hết m gam Al vào dung dịch NaOH được dung dịch X và 3,36 lít H2 (đktc). Rót từ từ đến hết V lít dung dịch HCl 0,2 M vào X thì thu được 5,46 gam kết tủa. Gía trị của m và V lần lượt là:
A. 2,7g và 0,36 lít
B. 2,7 g và 0,95 lít
C. 4,05g và 0,36 lít
D. Cả A và B
Giải:
nAl = nNaAlO2 = 2/3 nH2 = 0,1 mol
⇒m = 2,7g
Vì số mol NaAlO2 = 0,1 mol ⇒ Đồ thị của bài toán:
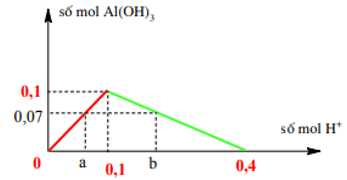
Từ đồ thị
Khi nH+ = a kết tủa chưa cực đại ⇒nH+ = a = n ↓ = 0,07
Khi nH+=b kết tủa bị hòa tan một phần
⇒nH+ = 4n↓ max - n↓ = 0,4 – 3.0,07= 0,19 mol
⇒ V = 0,35 hoặc 0,95 lít ⇒ Đáp án D
Ví dụ 10: Rót từ từ dung dịch HCl 0,1M vào 200 ml dung dịch K[Al(OH)4] 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V (ml) dung dịch HCl như hình bên dưới. Giá trị của a và b lần lượt là:
A. 200 và 1000.
B. 200 và 800.
C. 200 và 600.
D. 300 và 800.
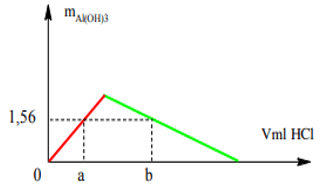
Ta có số mol Al(OH)3 trên đồ thị = 1,56 : 78 = 0,02 mol
⇒ nH+ = a = 0,02 mol (1).
Số mol K[Al(OH)4] = 0,04 mol ⇒ kết tủa cực đại = 0,04 mol.
Từ đồ thị: nH+ = b = 4n↓max – 3n↓ = 4.0,04 – 3.0,02 = 0,1⇒ nH+ = 0,1 mol (2).
Từ (1, 2) ⇒ a = 200 ml và b = 1000 ml.
⇒ Đáp án A
Bài tập tự luyện
Bài 1: Cho 200 ml dung dịch X gồm NaAlO2 0,1M và Ba(OH)2 0,1M tác dụng với V ml dung dịch HCl 2M, thu được 0,78 gam kết tủa. Tính V?
Lời giải:
nOH- = 0,04 mol; nAlO2- = 0,02 mol; nAl(OH)3 = 0,01 mol.
Ta có đồ thị:
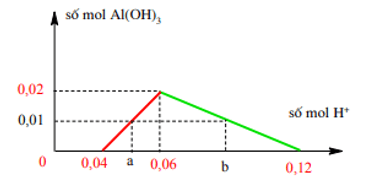
Từ đồ thị⇒nH+ = a = nOH- + n↓= 0,04 + 0,01 = 0,05 mol;
nH+ = b kết tủa bị hòa tan một phần
nH+ = b = nOH- + 4n↓max – 3n↓ = 0,04 + 4.0,02 – 3.0,01 = 0,09 mol
⇒V = 25 ml hoặc 45 ml.
Bài 2: Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 [hoặc Ba(AlO2)2], kết quả thí nghiệm được biểu diễn trên đồ thị sau:
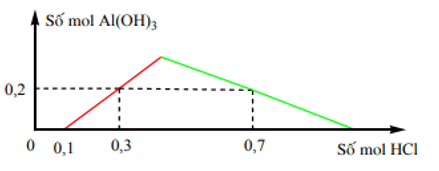
Giá trị của x và y lần lượt là:
A. 0,05 và 0,15.
B. 0,10 và 0,30.
C. 0,10 và 0,15.
D. 0,05 và 0,30.
Lời giải:
Từ đồ thị ta thấy: Khi bắt đầu xuất hiện kết tủa OH- đã được trung hòa hết bởi H+ ⇒n OH- = 0,1 mol ⇒ 2x = 0,1 ⇒ x = 0,05 mol.
Từ đồ thị ⇒khi kết tủa tan một phần
n HCl = 0,7 = n OH- + 4n ↓max – 3n ↓
⇒ n ↓max = (0,7 + 0,6 – 0,1 ):4 = 0,3 mol
Bảo toàn nguyên tố Al⇒ y = 0,15 mol
⇒ Đáp án A
Bài 3: Cho từ từ dung dịch chứa x mol NaOH vào 300 ml dung dịch ZnSO4 1,5M thu được 19,8 gam kết tủa. Giá trị của x là:
A. 0,4 mol hoặc 1,4 mol.
B. 0,4 mol hoặc 1,2 mol.
C. 0,4 mol hoặc 1,6 mol.
D. 0,5 mol hoặc 1,4 mol.
Lời giải:
Ta có: Zn2+ = 0,45 mol ⇒ kết tủa cực đại = 0,45 mol.
Số mol Zn(OH)2 = 0,2 mol.
Ta có đồ thị
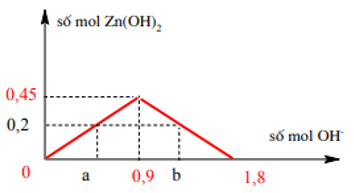
Từ đồ thị ⇒ a = 2n Zn2+ = 0,2.2 = 0,4 mol
và 1,8 - b = a ⇒ b = 1,4 mol( hình học)
Vậy x = 0,4 mol hoặc 1,4 mol. ⇒ Đáp án A
Bài 4: Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch gồm a mol HCl và b mol ZnSO4. Kết quả thí nghiệm được biểu diễn trên sơ đồ sau :
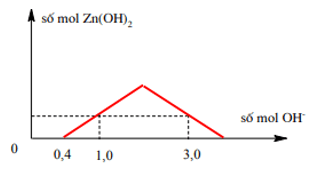
A. 1 : 2.
B. 3 : 2.
C. 2 : 3.
D. 3 : 4.
Lời giải:
Từ đồ thị khi bắt đầu xuất hiện kết tủa H+ được trung hòa hết bởi OH-
⇒ a = 0,4 mol (*).
n↓ max = b mol.
Ta có đồ thị:
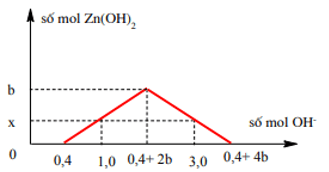
Từ đồ thị ⇒ 2x = 1 – 0,4 ⇒ x = 0,3 mol
Ta cũng có : 1,0 – 0,4 = 0,4 + 4b – 3,0 ⇒ b = 0,8 mol (**). ( Dựa vào hình học)
Từ (*, **) ⇒ a : b = 1 : 2. ⇒ Đáp án A
Bài 5: Nhỏ từ từ đến dư KOH vào dung dịch hỗn hợp gồm a mol HCl và x mol ZnSO4 ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x (mol) là:
A. 0,4.
B. 0,6.
C. 0,7.
D. 0,65.
Lời giải:
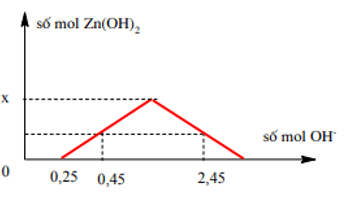
Từ đồ thị ⇒ a = 0,25 mol.
Dễ thấy : (0,45 – 0,25) = (0,25 + 4x) – 2,45 ⇒ x = 0,6 mol.
⇒ Đáp án B
Bài 6: Sục V lít CO2 (đktc) vào 200 ml dung dịch hỗn hợp KOH 0,5M và Ba(OH)2 0,375M thu được 11,82 gam kết tủa. Giá trị của V là:
A. 1,344l lít.
B. 4,256 lít.
C. 8,512 lít.
D. 1,344l lít hoặc 4,256 lít.
Lời giải:
Ta có : n Ba2+ = 0,075 mol ; n OH- = 0,25 mol ; n BaCO3 ↓ = 0,06 mol ;
n BaCO3 max = 0,075 mol.
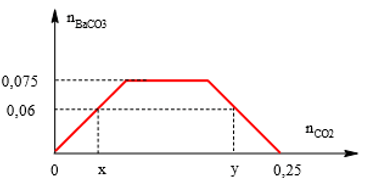
Từ đồ thị ⇒x = 0,06 mol và 0,25 – y = 0,06 ⇒ y = 0,19 mol
⇒ V = 1,344 lít hoặc V = 4,256 lít
⇒ Đáp án D
Bài 7: Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x là:
A. 0,12 mol.
B. 0,11 mol.
C. 0,13 mol.
D. 0,10 mol.
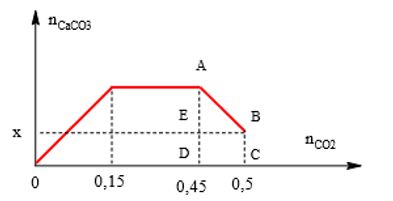
Lời giải:
Từ đồ thì suy ra: AD = 0,15; AE = CD = BE = 0,5 – 0,45 = 0,05 ⇒x = DE = AD – AE = 0,15 – 0,05 = 0,1 mol.
⇒ Đáp án D
Bài 8: Khi sục từ từ đến dư CO2 vào dung dịch có chứa 0,1 mol NaOH; x mol KOH và y mol Ba(OH)2, kết quả thí nghiệm thu được biểu diễn trên đồ thị sau:
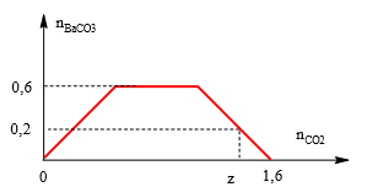
Giá trị của x, y, z lần lượt là:
A. 0,60; 0,40 và 1,50.
B. 0,30; 0,60 và 1,40.
C. 0,30; 0,30 và 1,20.
D. 0,20; 0,60 và 1,25.
Lời giải:
n ↓max = 0,6 mol ⇒ y = 0,6.
n OH- = 1,6⇒ 0,1 + x + 2y = 1,6 ⇒ x = 0,3 mol.
Từ đồ thị ⇒ 1,6 – z = 0,2 ⇒ z = 1,4 mol.
⇒ Đáp án B
Bài 9: Cho V(lít) khí CO2 hấp thụ hoàn toàn bởi 200 ml dung dịch Ba(OH)2 0,5M và NaOH 1,0M. Tính V để kết tủa thu được là cực đại?
A. 2,24 lít ≤ V ≤ 8,96 lít.
B. 2,24 lít ≤ V ≤ 5,6 lít.
C. 2,24 lít ≤ V ≤ 4,48 lít.
D. 2,24 lít ≤ V≤ 6,72 lít.
Lời giải:
Ta có: n Ba(OH)2 = 0,1 mol; n NaOH = 0,2 mol ⇒ n Ba2+ = 0,1 mol và n OH- = 0,4 mol. ⇒n BaCO3 max = 0,1 mol.
Để kết tủa max thì số mol CO32- ≥ 0,1 mol. Theo giả thiết ta có đồ thị:
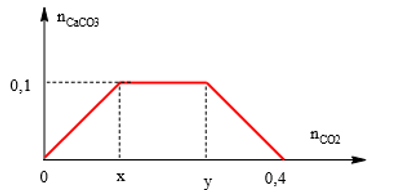
Theo sơ đồ ⇒ x = 0,1; 0,4 – y = x ⇒ y = 0,3.
Để kết tủa lớn nhất thì: x ≤ CO2 ≤ y hay 0,1 ≤ CO2 ≤ 0,3 (mol)
⇒ 2,24 ≤ V ≤ 6,72 (lít) ⇒ Đáp án D
Bài 10: Khi sục từ từ đến dư CO2 vào dung dịch hỗn hợp gồm a mol NaOH và b mol Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
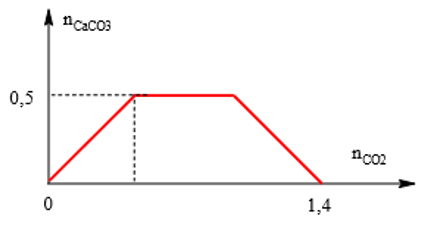
A. 4 : 5.
B. 5 : 4.
C. 2 : 3.
D. 4 : 3.
Lời giải:
n ↓max = 0,5 mol ⇒ b = 0,5 mol.
Mặt khác : n OH- = 1,4 = a + 2b ⇒ a = 0,4 mol ⇒ a : b = 4 : 5.
⇒ Đáp án A
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các phương pháp giải nhanh bài tập Hóa học hay khác:
- Phương pháp bảo toàn điện tích trong hóa học hay, chi tiết, có lời giải
- Phương pháp bảo toàn electron trong hóa học hay, chi tiết, có lời giải
- Phương pháp bảo toàn khối lượng trong hóa học cực hay, có lời giải
- Phương pháp bảo toàn nguyên tố trong hóa học cực hay, có lời giải
- Phương pháp chọn đại lượng thích hợp trong hóa học cực hay, có lời giải
- Phương pháp đường chéo trong hóa học cực hay, chi tiết, có lời giải
- Phương pháp trung bình trong hóa học cực hay, chi tiết, có lời giải
- Phương pháp quy đổi trong hóa học cực hay, chi tiết, có lời giải
- Phương pháp sử dụng phương trình ion thu gọn trong hóa học cực hay, có lời giải
- Phương pháp tăng giảm khối lượng trong hóa học cực hay, có lời giải
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

