Tốc độ phản ứng là gì (chi tiết nhất)
Bài viết Tốc độ phản ứng là gì lớp 10 chi tiết nhất là kiến thức có trong chương trình Hóa học 10 giúp học sinh nắm vững kiến thức trọng tâm về Tốc độ phản ứng.
Tốc độ phản ứng là gì (chi tiết nhất)
1. Tốc độ phản ứng là gì?
- Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), …
- Tốc độ phản ứng kí hiệu là v, đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1.
- Các phản ứng khác nhau xảy ra với tốc độ khác nhau:
2. Kiến thức mở rộng
2.1. Tốc độ trung bình của phản ứng
- Đa số các phản ứng có tốc độ giảm dần theo thời gian, để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình.
Như vậy: Tốc độ trung bình của phản ứng () là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát: aA + bB → dD + eE
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
Trong đó: ∆CA; ∆CB; ΔCD; ΔCE lần lượt là biến thiên lượng các chất A, B, D, E trong khoảng thời gian ∆t.
2.2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
a. Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Thông thường, khi nồng độ tăng, tốc độ phản ứng sẽ tăng.
- Giải thích:
+ Trong quá trình phản ứng, các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ, hình thành liên kết mới dẫn tới phản ứng hóa học được gọi là va chạm hiệu quả.
+ Khi nồng độ các chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn tới tốc độ phản ứng tăng.
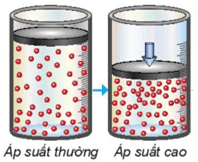
b. Ảnh hưởng của áp suất đến tốc độ phản ứng
- Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên. Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
- Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
c. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị γ = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
- Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
d. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
- Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
- Chú ý:
+ Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
+ Ngoài ra, có thể tăng diện tích bề mặt của một khối bằng cách tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất đó. Khi đó, diện tích bề mặt bao gồm diện tích bề mặt trong và diện tích bề mặt ngoài.
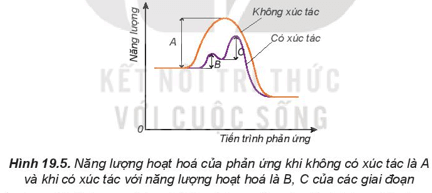
e. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
- Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó, số hạt có đủ, năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
- Chú ý:
+ Năng lượng hoạt hóa là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
+ Sau phản ứng, khối lượng và bản chất của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng hạt, độ xốp, … có thể thay đổi.
2.3. Một số ứng dụng của việc thay đổi tốc độ phản ứng
- Trong đời sống và sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, dùng chất xúc tác, …
3. Bài tập minh họa
Câu 1. Trong phản ứng điều chế khí oxygen trong phòng thí nghiệm bằng cách nhiệt phân muối potassium chlorate (KClO3):
(a) Dùng chất xúc tác manganese dioxide (MnO2).
(b) Nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao.
(c) Dùng phương pháp dời nước để thu khí oxygen.
Những biện pháp nào dưới đây được sử dụng để làm tăng tốc độ phản ứng là
A. a, c.
B. a, b.
C. b, c.
D. a, b, c.
Hướng dẫn giải
Đáp án đúng là: B
(a) Làm tăng tốc độ phản ứng do có chất xúc tác.
(b) Làm tăng tốc độ phản ứng do thực hiện ở nhiệt độ cao.
(c) Không ảnh hưởng đến tốc độ phản ứng.
Câu 2. Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau:
(1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4.
(2) Thêm dung dịch HCl 1M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt sắt thành bột sắt.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu cách thay đổi tốc độ phản ứng?
A. 1.
B. 4.
C. 3.
D. 2.
Hướng dẫn giải
Đáp án đúng là: C
Bao gồm : (1), (3), (4).
(2) Thể tích không ảnh hưởng đến tốc độ phản ứng.
Câu 3.Cho các phát biểu sau:
(a) Tốc độ của phản ứng hóa học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng hoặc sản phẩm tạo thành.
(b) Tốc độ của phản ứng hóa học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
(c) Tốc độ của phản ứng hóa học có thể có giá trị âm hoặc dương.
(d) Trong cùng một phản ứng hóa học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tùy thuộc vào hệ số cân bằng của chúng trong phương trình hóa học.
(e) Trong cùng một phản ứng hóa học, tốc độ tiêu thụ của chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Đáp án đúng là: B
Bao gồm: a, d.
(b) Sai vì tốc độ của phản ứng hóa học là độ biến thiên nồng độ trong một đơn vị thời gian.
(c) Sai vì tốc độ của phản ứng hóa học luôn có giá trị dương.
(e) Sai vì tốc độ tiêu thụ còn phụ thuộc vào hệ số cân bằng của chất phản ứng.
Câu 4.Cho các phát biểu sau:
(a) Tốc độ của phản ứng hóa học chỉ có thể được xác định theo sự thay đổi nồng độ chất phản ứng theo thời gian.
(b) Tốc độ của phản ứng hóa học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian.
(c) Theo công thức tính, tốc độ trung bình của phản ứng hóa học trong một khoảng thời gian nhất định là không thay đổi trong khoảng thời gian ấy.
(d) Dấu “–” trong biểu thức tính tốc độ trung bình theo biến thiên nồng độ chất phản ứng là để đảm bảo cho giá trị của tốc độ phản ứng không âm.
(e) Tốc độ trung bình của một phản ứng trong một khoảng thời gian nhất định được biểu thị bằng biến thiên nồng độ chất phản ứng hoặc sản phẩm tạo thành chia cho khoảng thời gian đó.
Số phát biểu không đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Đáp án đúng là: B
Bao gồm : a, b.
(a) Sai vì tốc độ của phản ứng hóa học còn đo bằng sự biến thiên khối lượng, thể tích, số mol.
(b) Sai vì tốc độ của phản ứng hóa học có thể được xác định từ sự thay đổi nồng chất sản phẩm tạo thành theo thời gian.
Câu 5. Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn?
A. Nhiệt độ.
B. Áp suất.
C. Diện tích tiếp xúc.
D. Chất xúc tác.
Hướng dẫn giải
Đáp án đúng là: B
Áp suất không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn.
Câu 6. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ chất phản ứng.
B. Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ....).
C. Nồng độ chất phản ứng.
D. Tỉ lệ mol của các chất trong phản ứng.
Hướng dẫn giải
Đáp án đúng là: D
Tỉ lệ mol của các chất trong phản ứngkhông ảnh hưởng đến tốc độ phản ứng.
Câu 7. Tốc độ của một phản ứng hóa học
A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
B. tăng khi nhiệt độ phản ứng tăng.
C. càng nhanh khi giá trị năng lượng hoạt hóa càng lớn.
D. không phụ thuộc vào diện tích bề mặt.
Hướng dẫn giải
Đáp án đúng là: B
Tốc độ của một phản ứng hóa học tăng khi nhiệt độ phản ứng tăng: Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu 8. Đối với phản ứng có chất khí tham gia thì nhận định nào dưới đây đúng?
A. Khi áp suất tăng thì tốc độ phản ứng giảm.
B. Khi áp suất tăng thì tốc độ phản ứng tăng.
C. Khi áp suất giảm thì tốc độ phản ứng tăng.
D. Áp suất không ảnh hưởng đến tốc độ phản ứng.
Hướng dẫn giải
Đáp án đúng là: B
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên. Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
Câu 9. Trong các cặp phản ứng sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như nhau thì cặp nào có tốc độ phản ứng lớn nhất?
A. Fe + dung dịch HCl 0,1 M.
B. Fe + dung dịch HCl 0,2 M.
C. Fe + dung dịch HCl 0,3 M.
D. Fe + dung dịch HCl 0,5 M.
Hướng dẫn giải
Đáp án đúng là: B
Dolượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như nhau nênkhi cho tác dụng với HCl nồng độ lớn nhất (0,5 M) thì tốc độ phản ứng lớn nhất.
Câu 10. Chọn câu đúng trong các câu dưới đây?
A. Bếp than đang cháy trong nhà cho ra ngoài trời sẽ cháy chậm hơn.
B. Sục CO2 vào Na2CO3 trong điều kiện áp suất thấp sẽ khiến phản ứng nhanh hơn.
C. Nghiền nhỏ vừa phải CaCO3 giúp phản ứng nung vôi xảy ra dễ dàng hơn.
D. Thêm MnO2 vào quá trình nhiệt phân KClO3 sẽ làm giảm lượng O2 thu được.
Hướng dẫn giải
Đáp án đúng là: C
Nghiền nhỏ vừa phải CaCO3 giúp tăng diện tiếp xúc từ đó phản ứng nung vôi xảy ra dễ dàng hơn.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

