Ca(OH)2 + Cl2 → H2O + CaCl2 + Ca(ClO)2 | Ca(OH)2 ra CaCl2 | Ca(OH)2 ra Ca(ClO)2 | Cl2 ra CaCl2 | Cl2 ra Ca(ClO)2
Phản ứng Ca(OH)2 + Cl2 hay Ca(OH)2 ra CaCl2 hoặc Ca(OH)2 ra Ca(ClO)2 hoặc Cl2 ra CaCl2hoặc Cl2 ra Ca(ClO)2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Ca(OH)2 có lời giải, mời các bạn đón xem:
2Ca(OH)2 + 2Cl2 → 2H2O + CaCl2 + Ca(ClO)2
1. Phương trình hoá học của phản ứng Cl2 tác dụng với Ca(OH)2
2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
Cách lập phương trình hoá học:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử và chất oxi hoá đều là: Cl2.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
2. Điều kiện để Cl2 tác dụng với Ca(OH)2
Phản ứng giữa Cl2 và Ca(OH)2 diễn ra ở 300C.
3. Cách tiến hành thí nghiệm
Dẫn khí clo vào ống nghiệm đã để sẵn dung dịch Ca(OH)2.
4. Hiện tượng phản ứng
Chất khí màu vàng lục Cl2 bị hoà lẫn vào dung dịch tạo chất bột trắng.
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
5.1. Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
5.2. Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 :
- Phương trình hóa học:
H2 + Cl22HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
5.3. Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp hydrochloric acid và axit hipoclozơ.
- Phương trình hóa học:
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
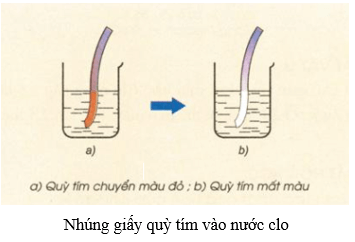
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
6. Bài tập vận dụng liên quan
Câu 1. Nước Gia-ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O. B.NaCl, NaClO, H2O.
C. NaCl, NaClO3, H2O. D. NaCl, NaClO4, H2O.
Hướng dẫn giải
Đáp án B
Cho khí clo tác dụng với dung dịch NaOH loãng ở nhiệt độ thường ta thu được nước Gia-Ven theo PTHH sau: 2NaOH + Cl2 → NaCl + NaClO + H2O.
Câu 2. Clorua vôi có công thức là
A. CaOCl. B. CaOCl2. C. Ca(OCl)2. D. CaCl2.
Hướng dẫn giải
Đáp án B
Vì công thức phân tử của clorua vôi là CaOCl2
Câu 3. Xét phản ứng: 2Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Trong phản ứng trên, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. môi trường.
Hướng dẫn giải
Đáp án B
Câu 4. Brom có lẫn một ít tạp chất là clo. Một trong các hoá chất có thể loại bỏ clo ra khỏi hỗn hợp là
A. KBr. B. KCl. C. H2O. D. NaOH.
Hướng dẫn giải
Đáp án A
- KBr được vì chỉ có clo phản ứng theo phản ứng sau:
Cl2 + 2KBr → 2KCl + Br2.
- KCl không được ⇒ Ko tách được clo.
- H2O xảy ra phản ứng của clo và brom với nước và một phần tan trong nước ⇒ ko tách được.
- NaOH cả brom và clo đều phản ứng ⇒ không tách được.
Câu 5. Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ dưới đây:
Khí X là
A. Cl2. B. N2. C. H2. D. NH3.
Hướng dẫn giải
Đáp án A
Phương pháp ngửa bình thu khí nặng hơn không khí => Cl2 ( M = 71 > 29)
Câu 6. Đun nóng Na với Cl2 thu được 11,7 gam muối. Khối lượng Na và thể tích khí clo (đktc) đã phản ứng là
A. 4,6gam; 2,24 lít. B. 2,3gam; 2,24 lít.
C. 4,6gam; 4,48lít. D. 2,3gam; 4,48 lít.
Hướng dẫn giải
Đáp án A
2Na + Cl2 → 2 NaCl
0,2 0,1 0,2 (mol).
Khối lượng Na là: 23 . 0,2 = 4,6g.
Thể tích Cl2: 0,1 . 22,4= 2,24 lít.
Câu 7. Cho clo tác dụng với vừa đủ với Fe rồi hòa tan lượng muối sinh ra vào nước được 100g dung dịch muối có nồng độ 16,25%. Khối lượng sắt và clo (đktc) đã dùng là
A. 0,56 gam; 2,24 lít
B. 5,6 gam; 3,36 lít
C. 11,2 gam; 4,48 lít
D. 1,12 gam; 2,4 lít
Hướng dẫn giải
Đáp án B
== 16,25g ⇒ = 0,1 mol
2Fe + 3Cl2 → 2FeCl3
0,1 0,15 0,1 (mol).
Khối lượng sắt là: 0,1.56 = 5,6g;
Thể tích clo là: 0,15. 22,4= 3,36 lít.
Câu 8: Cho 14 gam Fe vào bình chứa 10,08 lít clo (đktc) tác dụng với nung nóng rồi lấy chất rắn thu được hoà vào nước và khuấy đều thì thu được 500 g dung dịch X. Nồng độ phần trăm của dung dịch X là
A. 6,35% B. 9,19% C. 8,125% D. 11,43%
Hướng dẫn giải
Đáp án C
2Fe + 3Cl2 → 2FeCl3
Bài cho: 0,25 0,45
Phản ứng: 0,25 0,375 0,25
Sau phản ứng: 0 0,075 0,25
⇒ Clo dư
Khối lượng muối thu được là
m = = 0,25 . 162,5 = 40,625g
⇒ C% =8,125%
Câu 9. Cho 0,12 mol Al tác dụng vừa hết với đơn chất halogen X2 thu được 16,02 gam muối Y. Cho các phát biểu sau
(1) X thuộc chu kì 3, nhóm VIIA trong bảng HTTH.
(2) X oxi hóa Fe thành muối Fe2+ ở nhiệt độ cao.
(3) X là nguyên tố có độ âm điện lớn nhất trong nhóm halogen.
(4) Phản ứng giữa X2 và H2 gây nổ mạnh ở tỉ lệ thể tích 1:1.
(5) Dung dịch NaX không tác dụng với dung dịch AgNO3 dư.
(6) Muối NaXO được dùng để tẩy rửa.
(7) Điện phân dung dịch là phương pháp duy nhất để điều chế X2.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 6.
Hướng dẫn giải
Đáp án A
⇒ 0,12. (27 + 3MX) = 16,02
⇒ MX = 35,5 ⇒ X là Clo
Vậy các phát biểu (1); (4) và (6) đúng.
Câu 10. Cho m gam bột Fe tác dụng với khí Cl2 sau khi phản ứng kết thúc thu được m + 12,78 gam hỗn hợp X. Hoà tan hết hỗn hợp X trong nước cho đến khi X tan tối đa thì thu được dung dịch Y và 1,12 gam chất rắn. Giá trị của m là.
A. 5,6 gam B. 11,2 gam C. 16,8 gam D. 8,4 gam.
Hướng dẫn giải
Đáp án B
Bản chất phản ứng:
2Fe + 3Cl2 2FeCl3
Fe + 2FeCl3 → 3FeCl2
⇒ nFe pư = nClo
Xem thêm các phương trình hóa học hay khác:
- Ca(OH)2 + CaCl2 → 2CaO + 2HCl
- Ca(OH)2 + CaCl2 → 2CaHClO
- CaCl2 + BaS → BaCl2 + CaS ↓
- CaCl2 + HOOCCOOH → 2HCl + Ca(COO)2
- CaCl2 + (NH4)2C2O4 → 2NH4Cl + CaC2O4
- Ca(OH)2 + 2HCl → 2H2O + CaCl2
- Ca(OH)2 + H2SO4 → 2H2O + CaSO4 ↓
- Ca(OH)2 + 2H2SO4 → 2H2O + Ca(HSO4)2
- Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
- Ca(OH)2 + 2H2S → 2H2O + Ca(HS)2
- Ca(OH)2 + H2CO3 → CaCO3 ↓ + 2H2O
- Ca(OH)2 + 2H3PO4 → Ca(H2PO4)2 ↓ + 2H2O
- 3Ca(OH)2 + 2H3PO4 → 6H2O + CaHPO4
- 3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2 ↓ + 6H2O
- Ca(OH)2 + 2CH3COOH → (CH3COO)2Ca ↓ + 2H2O
- Ca(OH)2 + CO → CaCO3 ↓ + H2 ↑
- Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
- Ca(OH)2 + 2CO2 → Ca(HCO3)2
- Ca(OH)2 + Cl2 → CaOCl2 + H2O
- 6Ca(OH)2 + 6Cl2 → 6H2O + 5CaCl2 + Ca(ClO3)2
- Ca(OH)2 + SO2 → H2O + CaSO3 ↓
- Ca(OH)2 + 2SO2 → Ca(HSO3)2
- 2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
- Ca(OH)2 + N2O5 → Ca(NO3)2 + H2O
- Phản ứng nhiệt phân: Ca(OH)2 → CaO + H2O
- Ca(OH)2 + H2O2 → 2H2O + CaO2 ↓
- Ca(OH)2 + H2O + 6H2O2 → CaO2.8H2O
- Ca(OH)2 + 2H2CN2 → 2H2O + Ca(HCN2)2
- Al + Ca(OH)2 + H2O → H2 ↑ + Ca(AlO2)2
- Al2O3 + Ca(OH)2 → H2O + Ca(AlO2)2
- Ca(OH)2 + Zn → H2 ↑ + CaZnO2
- Ca(OH)2 + ZnO → H2O + CaZnO2
- Ca(OH)2 + 2NH4Cl → 2H2O + 2NH3 ↑ + CaCl2
- Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
- Ca(OH)2 + 2NaHCO3 → CaCO3 ↓ + 2H2O + Na2CO3
- Ca(OH)2 + NaHCO3 → CaCO3 ↓ + H2O + NaOH
- Ca(OH)2 + K2CO3 → CaCO3 ↓ + 2KOH
- Ca(OH)2 + 2KHCO3 → CaCO3 ↓ + 2H2O + K2CO3
- Ca(OH)2 + KHCO3 → CaCO3 ↓ + H2O + KOH
- Ca(OH)2 + Li2CO3 → CaCO3 ↓ + 2LiOH
- 2Ca(OH)2 + Mg(HCO3)2 → 2CaCO3 ↓+ 2H2O + Mg(OH)2
- Ca(OH)2 + Ba(HCO3)2 → CaCO3 ↓ + 2H2O + BaCO3 ↓
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 ↓ + 2H2O
- Al2(SO4)3 + 3Ca(OH)2 → 2Al(OH)3 + 3CaSO4 ↓
- Ca(H2PO4)2 + Ca(OH)2 → 2H2O + 2CaHPO4
- 3Ca(OH)2 + 2Na3PO4 → Ca3(PO4)2 + 6NaOH
- Ca(OH)2 + Rb2CO3 → CaCO3 ↓+ 2RbOH
- Ca(OH)2 + Cs2CO3 → CaCO3 ↓ + 2CsOH
- Ca(OH)2 + Ca(HSO4)2 → 2H2O + 2CaSO4 ↓
- 3Ca(OH)2 + 2FeCl3 → 3CaCl2 + 2Fe(OH)3 ↓
- Ca(OH)2 + CuCl2 → Cu(OH)2 ↓ + CaCl2
- Ca(OH)2 + 2CHCl2CH2Cl → 2H2O + CaCl2 + 2CH2CHCl
- Ca(OH)2 + CH2OH-CH2Cl ⇌ 2H2O+ CaCl2 + 2(CH2CH2)O ↑
- Ca(OH)2 + 2NaClO → 2NaOH + Ca(ClO)2
- Ca(OH)2 + NH4HCO3 → CaCO3 ↓ + 2H2O + NH3 ↑
- 3Ca(OH)2 + 2NH4H2PO4 → Ca3(PO4)2 ↓ + 6H2O + 2NH3 ↑
- Ca(OH)2 + 2NH4NO3 → Ca(NO3)2 + 2H2O + 2NH3 ↑
- Ca(OH)2 + NH4Br → 2H2O + 2NH3 ↑ + CaBr2
- 3Ca(OH)2 + 2Fe(NO3)3 → 3Ca(NO3)2 + 2Fe(OH)3 ↓
- Ca(OH)2 + 2HCOOC2H5 → 2C2H5OH + (HCOO)2Ca
- Ca(OH)2 + Na2SiO3 → 2NaOH + CaSiO3 ↓
- Ca(OH)2 + 2LiF → CaF2 ↓ + 2LiOH
- Ca(OH)2 + 2NH4F → CaF2 ↓+ 2NH4OH
- Ca(OH)2 + NH4HF2 → CaF2 ↓+ H2O + NH4OH
- Ca(OH)2 + NaHF2 → CaF2 ↓ + H2O + NaOH
- 2Al(OH)3 + Ca(OH)2 → 4H2O + Ca(AlO2)2
- Ca(OH)2 + K2SiO3 → 2KOH + CaSiO3 ↓
- (NH2)2CO + Ca(OH)2 → CaCO3 ↓+ 2NH3 ↑
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



