2-methyl-but-1-en C4H8 + Br2 | CH2=C(CH3)–CH3 + Br2 → CH2Br–C(CH3)Br–CH3
Phản ứng 2-methyl-but-1-en C4H8 + Br2 thuộc loại phản ứng cộng đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C4H8 có lời giải, mời các bạn đón xem:
CH2 = C(CH3)–CH3 + Br2 → CH2Br–C(CH3)Br–CH3
1. Phương trình phản ứng C4H8 tác dụng với Br2
C4H8 + Br2 → C4H8Br2
Phản ứng này thuộc loại phản ứng cộng.
2. Hiện tượng của phản ứng C4H8 tác dụng với Br2
- Màu nâu đỏ của dung dịch nhạt dần đến mất màu.
3. Cách tiến hành phản ứng C4H8 tác dụng với Br2
- Dẫn khí buten từ từ qua dung dịch brom thấy màu nâu đỏ của dung dịch nhạt dần đến mất màu.
4. Cách viết phương trình của phản ứng C4H8 tác dụng với Br2
Bước 1: Viết sơ đồ phản ứng:
C4H8 + Br2 → C4H8Br2
Bước 2: Đếm số nguyên tử mỗi nguyên tố trong 2 vế của phương trình hóa học.
Bước 3: Đặt hệ số sao cho số nguyên tử của mỗi nguyên tố ở 2 vế bằng nhau.
Bước 4: Hoàn thành phương trình hóa học:
C4H8 + Br2 → C4H8Br2
5. Mở rộng về tính chất hoá học của alkene
5.1. Phản ứng cộng
a) Phản ứng cộng hiđro (Phản ứng hiđro hoá)
CH2 = CH2 + H2 CH3 – CH3
b) Phản ứng cộng halogen (Phản ứng halogen hoá)
- alkene làm mất màu của dung dịch brom.
→ Phản ứng này dùng để nhận biết alkene.
Thí dụ:
CH2 = CH2 + Br2 → Br–CH2–CH2–Br
c) Phản ứng cộng HX (X là OH, Cl, Br,…)
Cộng nước
Thí dụ:
CH2 = CH2 + H – OH CH3 – CH2 – OH
Cộng axit HX
Thí dụ:
CH2 = CH2 + HCl → CH3 – CH2 – Cl
- Đối với các alkene có cấu tạo không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp hai sản phẩm.
Thí dụ:
* Quy tắc Mac-côp-nhi-côp: Trong phản ứng cộng HX (axit hoặc nước) vào liên kết C = C của alkene, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
5.2. Phản ứng trùng hợp
- Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polymer.
- Số lượng mắt xích trong một phân tử polymer gọi là hệ số trùng hợp, kí hiệu n.
Thí dụ: Trùng hợp etilen
5.3. Phản ứng oxi hoá
a) Oxi hoá hoàn toàn
CnH2n + O2 nCO2 + nH2O
⇒ Đốt cháy hoàn toàn alkene thu được
b) Oxi hoá không hoàn toàn
alkene làm mất màu dung dịch KMnO4 ⇒ Dùng để nhận biết alkene.
Thí dụ:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
6. Bài tập vận dụng liên quan
Câu 1: Để phân biệt etan và eten, phản ứng nào là thuận tiện nhất?
A. Phản ứng đốt cháy. B. Phản ứng với dung dịch brom.
C. Phản ứng cộng hiđro. D. Phản ứng trùng hợp.
Hướng dẫn giải
Đáp án B
Dẫn hỗn hợp khí qua dung dịch brom.
Khí eten làm mất màu dung dịch brom, khí etan không phản ứng với dung dịch brom thoát ra khỏi dung dịch.
CH2=CH2 + Br2 → CH2Br-CH2Br
Câu 2: hydrocarbon nào sau đây khi phản ứng với dung dịch brom thu được
1,2- đibrombutan?
A. But-1-en B. Butan
C. But-2-en D. 2-methylpropen
Hướng dẫn giải
Đáp án A
CH2 = CH – CH2 – CH3 + Br2 → CH2Br – CHBr – CH2 – CH3
(But – 1 – en) (1,2 – đibrombutan)
Câu 3: Dẫn từ từ 6,72 lít (đktc) hỗn hợp X gồm etilen và propilen và dung dịch brom, dung dịch brom bị nhạt màu, và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 9,8 gam. Thành phần phần trăm theo thể tích của etilen trong X là
A. 50,00% B. 66,67% C. 57,14% D. 28,57%
Hướng dẫn giải
Đáp án B
% = .100 = 66,67%
Câu 4: Cho hydrocarbon X phản ứng với brom (trong dung dịch) theo tỷ lệ mol 1 : 1 thì được chất hữu cơ Y (chứa 74,08% brom về khối lượng). Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau. Tên gọi của X là
A. but-1-en B. etilen C. but-2-en. D. propilen
Hướng dẫn giải
Đáp án A
.100 = 74,08%
→ MY = 216 → MX = 216 – 160 = 56 (C4H8)
Câu 5: Tổng hệ số cân bằng (với các hệ số là tối giản) của phản ứng:
CH3CH=CH2 + KMnO4 + H2O → CH3CHOH-CH2OH + MnO2 + KOH là
A. 16 B. 17 C. 18 D. 19
Hướng dẫn giải
Đáp án A
3CH3CH=CH2 + 2KMnO4 + 4H2O → 3CH3CHOH-CH2OH + 2MnO2 + 2KOH
Câu 6: Hỗn hợp X gồm H2 và C2H4 có tỷ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có khối lượng so với He là 5. Hiệu suất của phẩn ứng hiđro hóa là
A. 20% B. 25% C. 50% D. 40%
Hướng dẫn giải
Đáp án C
MX = 3,75.4 = 15 (g/mol); MY = 5.4 = 20 (g/mol)
Chọn 1 mol hỗn hợp X
→
Đặt số mol H2 phản ứng là a mol
C2H4 + H2 → C2H6
Áp dụng định luật bảo toàn khối lượng:
mX = mY → 15.1 = 20.nY → nY = 0,75 mol
Số mol hỗn hợp giảm bằng số mol H2 phản ứng
→ a = 1 – 0,75 = 0,25 mol
→ H% = = 50%
Câu 7: alkene X hợp nước tạo thành 3-ethylpentan-3-ol. Tên của X là
A. 3-ethylpent-2-en B. 3-ethylpent-3-en
C. 3-ethylpent-1-en D. 2-ethylpent-2-en
Hướng dẫn giải
Đáp án A
CH3CH=C(C2H5)CH2CH3 + H2O CH3CH2C(OH)(C2H5)CH2CH3
(3-ethylpent-2-en)
Câu 8: Cho 5,6 lít (đktc) hỗn hợp X gồm 2 hydrocarbon mạch hở đi thật chậm qua dung dịch Br2 dư. Sau phản ứng thấy có 24 gam Br2 tham gia phản ứng, khối lượng bình brom tăng 6,3 gam và có 2,24 lít (đktc) khí thoát ra khỏi bình. Biết tỉ khối của X so với H2 là 18,6. Hai hydrocarbon trong X là:
A. CH4 và C3H6. B. C2H6 và C4H8
C. C3H6 và C2H6 D. C2H4 và C3H8.
Hướng dẫn giải
Đáp án C
Có khí thoát ra khỏi bình brom chứng tỏ hỗn hợp chứa 1 alkane + 1 hydrocarbon không no.
nhỗn hợp = 5,6 : 22,4 = 0,25 mol
nalkane = 2,24 : 22,4 = 0,1 mol
nHydrocarbon không no = nhỗn hợp – nalkane = 0,25 – 0,1 = 0,15 mol
= 0,15 mol = nHydrocarbon không no → hydrocarbon không no là alkene
Malkene = 6,3 : 0,15 = 42 gam → C3H6
Mhỗn hợp = 37,2g → mhỗn hợp = 37,2.0,25 = 9,3 gam
→ malkane = 3g →Malkane = 30g → C2H6
Câu 9: Cho các chất sau:
(1) CH4; (2) CH3-CH3 ; (3) CH2=CH2; (4) CH3-CH=CH2
Các chất có khả năng tham gia phản ứng trùng hợp là:
A. 1, 2 B. 3, 4 C. 2, 3, 4 D. Cả 4 chất trên.
Hướng dẫn giải
Đáp án B
Các phân tử alkene có thể kết hợp với nhau tạo thành phân tử polymer mạch dài.
→ (3) CH2=CH2; (4) CH3-CH=CH2 có khả năng tham gia phản ứng trùng hợp
Câu 10: alkene A phản ứng với dung dịch KMnO4 loãng, lạnh thu được sản phẩm hữu cơ B với MB = 1,81MA. A có CTPT:
A. C2H4. B. C3H6. C. C4H8. D. C5H10.
Hướng dẫn giải
Đáp án B
3CnH2n (A) + 2KMnO4 + 3H2O → 3CnH2n(OH)2 (B) + 2MnO2 + 2KOH
→ n = 3
→ alkene là C3H6
Xem thêm các phương trình hóa học hay khác:
- CH3-CH=CH–CH3 + H2 → CH3–CH2–CH2–CH3
- CH2=CH–CH2–CH3 + H2 → CH3–CH2–CH2–CH3
- CH2 = C(CH3)–CH3 + H2 → CH3–CH(CH2)–CH3
- CH2=CH–CH2– CH3 + Br2 → CH2Br–CH2Br–CH2 - CH3
- CH3-CH=CH–CH3 + Br2 → CH3-CHBr–CHBr-CH3
- CH2=CH–CH2–CH3 + HBr → CH3-CHBr–CH2–CH3
- CH3- C(CH3)=CH2 + HBr → CH3–C(CH3)Br–CH3
- CH3-CH=CH–CH3 + HBr → CH3–CH2–CHBr-CH3
- CH3-CH=CH–CH3 + HCl → CH3–CH2–CHCl-CH3
- CH3 - C(CH3)=CH2 + HCl → CH3–C(CH3)Cl–CH3
- CH2=CH-CH2-CH3 + HCl → CH3–CHCl–CH2–CH3
- nCH3-CH=CH–CH3 → (-CH(CH3)–CH(CH3)-)n
- C4H8 + 6O2 → 4CO2 + 4H2O
- 3C4H8 + 4H2O + 2KMnO4 → 3C4H8(OH)2 + 2MnO2 + 2KOH
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

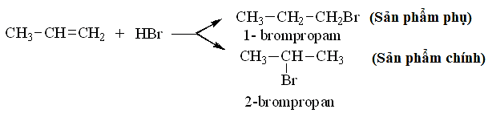
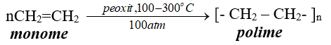





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



