C2H4 + HCl | CH2=CH2 + HCl → CH2Cl–CH3 | CH2=CH2 ra CH2Cl–CH3
Phản ứng C2H4 + HCl hoặc CH2=CH2 + HCl hay CH2=CH2 ra CH2Cl–CH3 thuộc loại phản ứng cộng đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C2H4 có lời giải, mời các bạn đón xem:
CH2=CH2 + HCl → CH2Cl–CH3
1. Phương trình phản ứng etilen tác dụng với HCl
CH2 = CH2 + HCl → CH3 – CH2 – Cl
2. Hiện tượng của phản ứng etilen tác dụng với HCl
- Tạo dung dịch không màu, không có khả năng làm mất màu dung dịch nước brom.
3. Cách tiến hành phản ứng etilen tác dụng với HCl
- Dẫn khí etilen vào ống nghiệm chứa hydrochloric acid HCl.
4. Mở rộng về tính chất hoá học của alkene
4.1. Phản ứng cộng
a) Phản ứng cộng hiđro (Phản ứng hiđro hoá)
CH2 = CH2 + H2 CH3 – CH3
b) Phản ứng cộng halogen (Phản ứng halogen hoá)
- alkene làm mất màu của dung dịch brom.
→ Phản ứng này dùng để nhận biết alkene.
Thí dụ:
CH2 = CH2 + Br2 → Br–CH2–CH2–Br
c) Phản ứng cộng HX (X là OH, Cl, Br,…)
Cộng nước
Thí dụ:
CH2 = CH2 + H – OH CH3 – CH2 – OH
Cộng axit HX
Thí dụ:
CH2 = CH2 + HCl → CH3 – CH2 – Cl
- Đối với các alkene có cấu tạo không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp hai sản phẩm.
Thí dụ:
* Quy tắc Mac-côp-nhi-côp: Trong phản ứng cộng HX (axit hoặc nước) vào liên kết C = C của alkene, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
4.2. Phản ứng trùng hợp
- Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polymer.
- Số lượng mắt xích trong một phân tử polymer gọi là hệ số trùng hợp, kí hiệu n.
Thí dụ: Trùng hợp etilen
4.3. Phản ứng oxi hoá
a) Oxi hoá hoàn toàn
CnH2n + O2 nCO2 + nH2O
⇒ Đốt cháy hoàn toàn alkene thu được
b) Oxi hoá không hoàn toàn
alkene làm mất màu dung dịch KMnO4 ⇒ Dùng để nhận biết alkene.
Thí dụ:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
5. Bài tập vận dụng liên quan
Câu 1: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là
A. 2,240. B. 2,688. C. 4,480. D. 1,344.
Hướng dẫn giải:
Đáp án D
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2(đen) + 2KOH.
= 0,2.0,2 = 0,04 mol.
Theo phương trình: .= = 0,06 mol.
→ V = 0,06.22,4 = 1,344 lít.
Câu 2: Trùng hợp m tấn etilen thu được 1 tấn polyethylene (PE) với hiệu suất phản ứng bằng 80%. Giá trị của m là
A. 1,25. B. 0,80. C. 1,80. D. 2,00.
Hướng dẫn giải
Đáp án A
Bảo toàn khối lượng: metilen (lý thuyết) = mpolyethylene = 1 tấn.
→ metilen thực tế = = 1,25 tấn.
Câu 3: Ba hydrocarbon X, Y, Z kế tiếp nhau trong dãy đồng đẳng, trong đó khối lượng phân tử Z gấp đôi khối lượng phân tử X. Đốt cháy 0,1 mol chất Y, sản phẩm khi hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư, thu được số gam kết tủa là
A. 30 gam. B. 10 gam. C. 40 gam. D. 20 gam.
Hướng dẫn giải
Đáp án A
Phân tử Z hơn phân tử X hai nhóm CH2 → MZ = MX + 28
Khối lượng phân tử Z gấp đôi khối lượng phân tử X → MZ = 2MX
→ 2MX = MX + 28 → MX = 28 → X là C2H4
Vậy Y là C3H6
Bảo toàn C có số mol CO2 sinh ra khi đốt Y là 3.0,1 = 0,3 mol
Hấp thụ CO2 vào Ca(OH)2 dư → = 0,3 mol
→ = 0,3.100 = 30 gam.
Câu 4: Dẫn từ từ 6,72 lít (đktc) hỗn hợp X gồm etilen và propilen và dung dịch brom, dung dịch brom bị nhạt màu, và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 9,8 gam. Thành phần phần trăm theo thể tích của etilen trong X là
A. 50,00%. B. 66,67%. C. 57,14%. D. 28,57%.
Hướng dẫn giải
Đáp án B
% = .
Câu 5: Đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm một alkane và một alkene, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của alkene có trong X là
A. 40%. B. 50%. C. 25%. D. 75%.
Hướng dẫn giải
Đáp án D
nalkane = - = 0,4 – 0,35 = 0,05 (mol)
nalkene = 0,2 – 0,05 = 0,15 mol
→ %Valkene = .100% = 75%.
Câu 6: Hỗn hợp X gồm propene và một alkene đồng đẳng. Đốt cháy hoàn toàn 1 mol hỗn hợp X cần 4,75 mol O2. alkene còn lại trong X có thể là
A. buten. B. propan. C. etan. D. eten.
Hướng dẫn giải
Đáp án A
→ = 4,75 → n = 3,17
Hỗn hợp chứa propene có 3C, vậy chất còn lại phải có > 3C, dựa vào đáp án chọn C4H8
Câu 7: Một hydrocarbon X cộng hợp với axit HCl theo tỷ lệ mol 1 : 1 tạo sản phẩm có thành phần khối lượng clo là 45,223 %. Công thức phân tử của X là
A. C4H8. B. C3H6. C. C3H8. D. C2H4.
Hướng dẫn giải
Đáp án B
X + HCl → Y (CxHyCl)
→ MY = 78,5
→ MX = 78,5 – 36,5 = 42 (C3H6).
Câu 8: Cho hydrocarbon X phản ứng với brom (trong dung dịch) theo tỷ lệ mol 1 : 1 thì được chất hữu cơ Y (chứa 74,08% brom về khối lượng). Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau. Tên gọi của X là
A. but-1-en.
B. etilen.
C. but-2-en.
D. propilen.
Hướng dẫn giải
Đáp án A
→ MY = 216 → MX = 216 – 160 = 56 (C4H8).
Câu 9: Tổng hệ số cân bằng (với các hệ số là tối giản) của phản ứng:
CH3CH=CH2 + KMnO4 + H2O → CH3CHOH-CH2OH + MnO2 + KOH là
A. 16. B. 17. C. 18. D. 19.
Hướng dẫn giải
Đáp án A
3CH3CH=CH2 + 2KMnO4 + 4H2O → 3CH3CHOH-CH2OH + 2MnO2 + 2KOH.
Câu 10: Hỗn hợp X gồm H2 và C2H4 có tỷ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có khối lượng so với He là 5. Hiệu suất của phản ứng hiđro hóa là
A. 20%. B. 25%.
C. 50%. D. 40%.
Hướng dẫn giải
Đáp án C
MX = 3,75.4 = 15 (g/mol); MY = 5.4 = 20 (g/mol)
Chọn 1 mol hỗn hợp X
→
Đặt số mol H2 phản ứng là a mol
C2H4 + H2 → C2H6
Áp dụng định luật bảo toàn khối lượng:
mX = mY → 15.1 = 20.nY → nY = 0,75 mol
Số mol hỗn hợp giảm bằng số mol H2 phản ứng
→ a = 1 – 0,75 = 0,25 mol
→ H% =
Xem thêm các phương trình hóa học hay khác:
- CH2=CH2 + H2 → CH3–CH3
- CH2=CH2 + Br2 → CH2Br–CH2Br
- CH2=CH2 + Cl2 → CH2Cl–CH2Cl
- CH2=CH2 + HBr → CH2Br–CH3
- CH2=CH2 + H2O → CH2OH–CH3
- CH2=CH2 + H2SO4 → CH3–CH2OSO3H
- nCH2=CH2 → (-CH2-CH2 -)n
- C2H4 + 3O2 → 2CO2 + 2H2O
- 3CH2=CH2 + 4H2O + 2KMnO4 → 3OH-CH2-CH2 – OH + 2MnO2 + 2KOH
- CH2=CH2 + O2 → CH3CHO
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

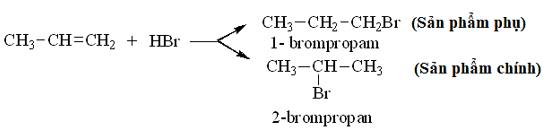
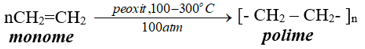





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



