CH4 + Cl2 → HCl + CH2Cl2 | CH4 ra CH2Cl2
Phản ứng CH4 + Cl2 hay CH4 ra CH2Cl2 thuộc loại phản ứng thế bởi halogen , phản ứng halogen hóa đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về CH4 có lời giải, mời các bạn đón xem:
CH4 + 2Cl2 → 2HCl + CH2Cl2
1. Phương trình phản ứng CH4 tác dụng với Cl2
CH4 + 2Cl2 CH2Cl2 + 2HCl
2. Hiện tượng của phản ứng CH4 tác dụng với Cl2
Trước khi chiếu sáng hoặc đun nóng hỗn hợp phản ứng có màu vàng (của khí clo). Sau khi phản ứng xảy ra hỗn hợp sản phẩm thu được không có màu.
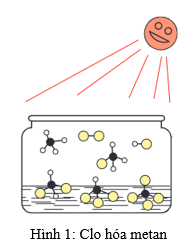
3. Cách tiến hành phản ứng CH4 tác dụng với Cl2
- Khi có ánh sáng hoặc đun nóng, khí methane (CH4) phản ứng với khí clo (Cl2).
4. Mở rộng về tính chất hoá học của alkane
- Ở nhiệt độ thường, các alkane không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa như dung dịch KMnO4 (thuốc tím)...
- Khi chiếu sáng hoặc đun nóng, các alkane dễ dàng tham gia các phản ứng thế, phản ứng tách hiđro và phản ứng cháy.
4.1. Phản ứng thế bởi halogen
- Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử methane.
Phương trình hóa học:
CH4 + Cl2 CH3Cl + HCl
CH3Cl + Cl2 CH2Cl2 + HCl
CH2Cl2 + Cl2 CHCl3 + HCl
CHCl3 + Cl2 CCl4 + HCl
- Các đồng đẳng của methane cũng tham gia phản ứng thế tương tự methane.
Nhận xét:
- Nguyên tử hiđro liên kết với nguyên tử cacbon bậc cao hơn dễ bị thế hơn nguyên tử hiđro liên kết với nguyên tử cacbon bậc thấp hơn.
4.2. Phản ứng tách
- Dưới tác dụng của nhiệt và chất xúc tác thích hợp, các alkane có phân tử khối nhỏ bị tách hiđro thành hydrocarbon không no tương ứng.
Thí dụ:
CH3 – CH3 CH2 = CH2 + H2
- Ở nhiệt độ cao và chất xúc tác thích hợp, ngoài việc bị tách hiđro, các alkane còn có thể bị phân cắt mạch cacbon tạo thành các phân tử nhỏ hơn.
Thí dụ:
CH3 – CH2 – CH3
4.3. Phản ứng oxi hóa
- Khi bị đốt, các alkane đều cháy, tỏa nhiều nhiệt.
CnH2n + 2 + O2 nCO2 + (n + 1)H2O
5. Bài tập vận dụng liên quan
Câu 1: Đốt cháy 4,8 gam methane trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít
B. 4,48 lít
C. 5,60 lít
D. 6,72 lít
Hướng dẫn giải:
Đáp án D
Số mol CH4 là: = 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,3 mol
Vậy thể tích CO2 thu được là: V = 0,3.22,4 = 6,72 lít.
Câu 2: Tính chất vật lý của methane là
A. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
B. Chất lỏng, không màu, tan nhiều trong nước.
C. Chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước.
D. Chất khí, màu vàng lục, tan nhiều trong nước.
Hướng dẫn giải:
Đáp án A
Tính chất vật lý của methane là chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Câu 3: Phản ứng hóa học đặc trưng của methane là
A. Phản ứng phân hủy
B. Phản ứng tách
C. Phản ứng cộng
D. Phản ứng thế
Hướng dẫn giải:
Đáp án D
Phản ứng hóa học đặc trưng của methane là phản ứng thế.
Câu 4: Thể tích khí oxi cần dùng để đốt cháy hết 4,48 lít khí methane là
A. 6,72 lít
B. 8,96 lít
C. 9,52 lít
D. 10,08 lít
Hướng dẫn giải:
Đáp án B
Số mol CH4 là: = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có = 0,4 mol
Vậy thể tích khí oxi cần dùng là = 0,4.22,4 = 8,96 lít.
Câu 5: Tính chất hóa học nào sau đây không phải của methane?
A. Làm mất màu dung dịch nước brom.
B. Tác dụng với oxi tạo thành CO2 và nước.
C. Tham gia phản ứng thế.
D. Tác dụng với clo khi có ánh sáng.
Hướng dẫn giải:
Đáp án A
methane không làm mất màu dung dịch brom.
Câu 6: Điều kiện để xảy ra phản ứng giữa methane và khí clo là
A. Có ánh sáng
B. Có axit làm xúc tác
C. Có sắt làm xúc tác
D. Làm lạnh.
Hướng dẫn giải:
Đáp án A
Điều kiện để xảy ra phản ứng giữa methane và khí clo là có ánh sáng
Phương trình phản ứng:
Câu 7: Khối lượng CO2 và H2O thu được khi đốt cháy 16 gam khí methane là
A. 44 gam và 36 gam
B. 44 gam và 18 gam
C. 22 gam và 18 gam
D. 22 gam và 36 gam
Hướng dẫn giải:
Đáp án A
Số mol của CH4 là: = 1 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có:
= 1 mol suy ra = 1.44 = 44 gam
= 2 mol suy ra = 2.18 = 36 gam
Câu 8: Chọn câu đúng trong các câu sau:
A. methane có nhiều trong khí quyển.
B. methane có nhiều trong nước biển.
C. methane có nhiều trong nước ao, hồ.
D. methane có nhiều trong các mỏ khí, mỏ dầu và mỏ than.
Hướng dẫn giải:
Đáp án D
methane có nhiều trong các mỏ khí, mỏ dầu và mỏ than.
Câu 9: Thành phần phần trăm về khối lượng của các nguyên tố cacbon và hiđro trong CH4 lần lượt là
A. 40% và 60%
B. 80% và 20%
C. 75% và 25%
D. 50% và 50%
Hướng dẫn giải:
Đáp án C
Ta có: %mC == 75%
%mH = 100% - 75% = 25%
Câu 10: khí methane có lẫn khí carbonic, để thu được khí methane tinh khiết cần
A. Dẫn hỗn hợp qua nước vôi trong dư.
B. Đốt cháy hỗn hợp rồi dẫn qua nước vôi trong.
C. Dẫn hỗn hợp qua bình đựng dung dịch H2SO4.
D. Dẫn hỗn hợp qua bình đựng dung dịch brom dư.
Hướng dẫn giải:
Đáp án A
khí methane có lẫn khí carbonic, để thu được khí methane tinh khiết cần dẫn hỗn hợp khí qua nước vôi trong dư.
Khí CO2 phản ứng bị giữ lại, khí methane không phản ứng thoát ra khỏi dung dịch thu được methane tinh khiết.
Phương trình phản ứng: CO2 + Ca(OH)2 → CaCO3↓ + H2O
Xem thêm các phương trình hóa học hay khác:
- CH4 + Cl2 → CH3Cl + HCl
- CH4 + 2O2 → CO2 + H2O
- CH4 + O2 → H2O + HCHO
- 2CH4 → C2H2 + 3H2
- CH4 + 3Cl2 → 3HCl + CHCl3
- CH4 + 4Cl2 → 4HCl + CCl4
- CH4 + Br2 → CH3Br + HBr
- CH4 + 2Br2 → 2HBr + CH2Br2
- CH4 + H2O → CO + 3H2
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



