Fe + H2SO4 (đặc nóng) → Fe2(SO4)3 + SO2 + H2O | Fe + H2SO4 ra SO2
Phản ứng Fe + H2SO4 đặc, nóng (hay sắt tác dụng với H2SO4 đặc, nóng) sinh ra SO2 thuộc loại phản ứng oxi hóa - khử thường gặp trong các đề thi. Dưới đây là phản ứng hoá học đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Fe và H2SO4 có lời giải, mời các bạn đón đọc.
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
1. Phương trình phản ứng Fe tác dụng H2SO4 đặc, nóng
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
2. Cân bằng phản ứng oxi hoá khử (theo phương pháp thăng bằng electron)
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử: Fe; chất oxi hoá: H2SO4.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Fe + 6H2SO4→ Fe2(SO4) + 3SO2 + 6H2O
3. Điều kiện phản ứng
Fe tác dụng với H2SO4 đặc khi đun nóng.
4.Cách tiến hành phản ứng
- Nhỏ từ từ H2SO4 đặc vào ống nghiệm có chứa sẵn 1 đinh sắt nhỏ.
- Đun nóng ống nghiệm trên ngọn lửa đèn cồn.
5. Hiện tượng hóa học
Sắt (Fe) tan dần trong dung dịch và sinh ra khí không màu, mùi hắc là sulfur dioxide (SO2).
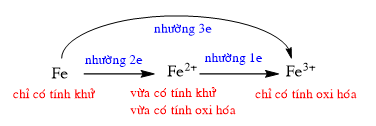
6. Tính chất hóa học của Fe
Fe là chất khử trung bình. Trong các phản ứng, Fe có thể nhường 2 hoặc 3e:
Fe → Fe3+ + 3e; Fe → Fe2+ + 2e
6.1. Tác dụng với các phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hoá +2 hoặc +3. Sắt tác dụng với hầu hết các phi kim khi đun nóng:
- Với halogen → muối sắt (III) halogenua (trừ iot tạo muối sắt II):
2Fe + 3X2 2FeX3
Ví dụ:
2Fe + 3Cl2 2FeCl3;
Fe + I2 FeI2
- Với O2:
3Fe + 2O2 Fe3O4
Thực tế khi giải các bài tập thường gặp trường hợp tạo ra hỗn hợp gồm Fe và các oxit sắt.
- Với S:
Fe + S FeS
6.2. Tác dụng với dung dịch axit
a. Với H+ (HCl, H2SO4 loãng... ) → muối sắt (II) + H2
Fe + 2HCl → FeCl2 + H2;
Fe + H2SO4 loãng → FeSO4 + H2
B. Tác dụng với các axit có tính oxi hóa mạnh (HNO3, H2SO4 đậm đặc)
- Fe thụ động với H2SO4 đặc, nguội và HNO3 đặc, nguội → có thể dùng thùng Fe chuyên chở axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
- Với dung dịch HNO3 loãng: tạo muối sắt (III) + NO + H2O
Fe + 4HNO3 (loãng) → Fe(NO3)3 + NO + 2H2O
- Với dung dịch HNO3 đậm đặc, nóng: tạo muối muối sắt (III) + NO2 + H2O
Fe + 6HNO3 Fe(NO3)3 + 3NO2 + 3H2O
- Với dung dịch H2SO4 đậm đặc, nóng: tạo muối sắt (III) + SO2 + H2O
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
(**) Chú ý: sản phẩm sinh ra trong phản ứng của Fe với HNO3 hoặc H2SO4 đậm đặc là muối sắt (III), nhưng nếu sau phản ứng có Fe dư hoặc có Cu thì tiếp tục xảy ra phản ứng:
2Fe3+ + Fe → 3Fe2+ hoặc 2Fe3+ + Cu → 2Fe2+ + Cu2+
6.3. Tác dụng với dung dịch muối
- Fe có thể khử được ion các kim loại đứng sau nó trong dãy điện hóa ra khỏi muối → muối sắt (II) + kim loại.
Ví dụ: Fe + CuCl2 → Cu + FeCl2
- Fe tham gia phản ứng với muối Fe3+ → muối sắt (II): 2FeCl3 + Fe → 3FeCl2
Chú ý: Với muối Ag+, Fe có thể tham gia phản ứng để tạo thành muối Fe3+:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag
6.4. Tác dụng với nước
Fe không tác dụng với nước ở nhiệt độ thường, ở nhiệt độ cao, sắt phản ứng mạnh với hơi nước:
3Fe + 4H2O Fe3O4 + 4H2
Fe + H2O FeO + H2
7. Tính chất hoá học của H2SO4
7.1. Tính chất của dung dịch axit sunfuric loãng
H2SO4 loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
Ví dụ:
H2SO4 (loãng) + Mg → MgSO4 + H2 (↑)
3H2SO4 (loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
Chú ý: Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với H2SO4 loãng.
Khi Fe tác dụng với H2SO4 loãng, sản phẩm thu được là muối sắt (II)
H2SO4 (loãng) + Fe → FeSO4 + H2 (↑)
- Tác dụng với bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
- Tác dụng với basic oxide tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + CuO → CuSO4 + H2O
H2SO4 + Na2O → Na2SO4 + H2O
- Tác dụng với một số muối tạo thành muối sunfat và axit mới
Ví dụ:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
7.2. Tính chất của axit sunfuric đặc
a) Tính oxi hóa mạnh
+ Axit sunfuric đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại khử mạnh như Mg).
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
Chú ý: Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội.
+ Tác dụng với nhiều phi kim:
C + 2H2SO4 CO2 + 2SO2 + 2H2O
S + 2H2SO4 3SO2 + 2H2O
+ Tác dụng với nhiều hợp chất có tính khử:
2FeO + 4H2SO4 Fe2(SO4)3 + SO2 + 4H2O
2KBr + 2H2SO4 Br2 + SO2 + 2H2O + K2SO4
b) H2SO4 đặc có tính háo nước
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O
8. Bài tập vận dụng liên quan
Câu 1. Những nhận định sau về kim loại sắt:
(1) Sắt còn có trong hồng cầu của máu, giúp vận chuyển oxi tới các tế bào.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trong tự nhiên sắt tồn tại ở dạng hợp chất, trong các quặng sắt
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
A. 3.
B. 4.
C. 5.
D. 6.
Hướng dẫn giải
Đáp án đúng là: C
(1) Sắt còn có trong hồng cầu của máu, giúp vận chuyển oxi tới các tế bào → đúng
(2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội → đúng.
(4) Quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất → đúng.
(5) Trong tự nhiên sắt tồn tại ở dạng hợp chất, trong các quặng sắt → đúng.
(6) Kim loại sắt có thể khử được ion Fe3+ → đúng.
Câu 2. Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe (II)?
A. Cl2.
B. dung dịch HNO3 loãng.
C. dung dịch AgNO3 dư.
D. dung dịch HCl đặc.
Hướng dẫn giải
Đáp án đúng là: D
Phương trình phản ứng minh họa:
Fe + 2HCl → FeCl2 + H2
Câu 3: Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch H2SO4 dư, thu được 4,48 lít khí H2 và dung dịch chứa m gam muối. Giá trị của m là
A. 17,7.
B. 18,1.
C. 11,6.
D. 23,1.
Hướng dẫn giải
Đáp án đúng là: D
Sơ đồ phản ứng: hỗn hợp + H2SO4 Muối + H2.
= 0,2 (mol) = 0,2 (mol).
m = mmuối = m(Al, Mg) + = 3,9 + 0,2×96 = 23,1 (gam).
Câu 4: Nung hợp chất X trong không khí đến khối lượng không đổi, thu được Fe2O3 và H2O. Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra. Hợp chất X là
A. Fe(OH)3.
B. Fe(OH)2.
C. FeO.
D. Fe(NO3)2.
Hướng dẫn giải
Đáp án đúng là: B
Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra.
X là hiđroxit sắt(II): Fe(OH)2.
Phương trình hóa học:
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Fe(OH)2 + 4HNO3 Fe(NO3)3 + NO2 + 3H2O
Câu 5. Chất nào sau đây tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO?
A. FeO.
B. Fe2O3.
C. Fe(OH)3.
D. Fe2(SO4)3.
Hướng dẫn giải
Đáp án đúng là: A
Để tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO thì hợp chất sắt phải có số oxi hóa của Fe ≠ +3.
FeO tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO.
3FeO + 10HNO3 3Fe(NO3)3 + NO + 5H2O
Câu 6: Kim loại tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối là
A. Fe.
B. Cu.
C. Ag.
D. Mg.
Hướng dẫn giải
Đáp án đúng là: D
Kim loại Mg tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối.
Mg + Cl2 MgCl2
Mg + 2HCl MgCl2 + H2
Loại A vì: Kim loại Fe tác dụng với khí Cl2 và dung dịch HCl thu được hai muối khác nhau.
2Fe + 3Cl2 2FeCl3
Fe + 2HCl FeCl2 + H2
Loại B vì: Cu không phản ứng với dung dịch HCl.
Loại C vì: Ag không phản ứng với dung dịch HCl.
Câu 7: Cho m gam bột Fe tác dụng hoàn toàn với một lượng dư dung dịch CuSO4 thu được 9,6 gam Cu. Giá trị m là
A. 8,4.
B. 9,75.
C. 3,25.
D. 13,0.
Hướng dẫn giải
Đáp án đúng là: A
Fe + CuSO4 ® FeSO4 + Cu.
nFe = nCu = 0,15 (mol).
m = mFe = 0,15×56 = 8,4 (gam).
Câu 8: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở to cao. Sau phản ứng hỗn hợp chất rắn còn lại là
A. Cu, Fe, Zn, MgO.
B. Cu, Fe, ZnO, MgO.
C. Cu, FeO, ZnO, MgO.
D. Cu, Fe, Zn, Mg.
Hướng dẫn giải
Đáp án đúng là: A
Sơ đồ phản ứng: Oxit + H2 Rắn + CO2.
Hỗn hợp chất rắn sau phản ứng gồm: Cu, Fe, Zn, MgO.
Câu 9: Cho 41 gam hỗn hợp bột gồm Zn và Fe vào 500 ml dung dịch CuSO4 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 43,2 gam hỗn hợp kim loại. Phần trăm khối lượng của Fe trong hỗn hợp ban đầu là
A. 56,37%.
B. 37,58%.
C. 68,29%.
D. 43,62%.
Hướng dẫn giải
Đáp án đúng là: C
= 0,5 (mol).
Tính khử: Zn > Fe Thứ tự kim loại phản ứng với dung dịch CuSO4: Zn, Fe.
Khối lượng kim loại tăng sau phản ứng Fe có tham gia phản ứng với dung dịch CuSO4.
Nếu CuSO4 phản ứng hoàn toàn thì: mCu = 0,5×64 = 32 < 43,2 ® Kim loại Fe còn dư sau phản ứng.
mFe (dư) = 43,2 – 32 = 11,2 (gam).
Phương trình hóa học:
Zn + CuSO4 ZnSO4 + Cu
x x x (mol)
Fe + CuSO4 FeSO4 + Cu
y y y (mol)
Gọi nZn = x (mol); nFe(pư) = y (mol)
mKL tăng = 64×(x + y) – (65x + 56y) = 43,2 – 41 = 2,2
8y = 2,2 + x (*)
Ta có: 65x + 56y + 11,2 = 41 (**)
Từ (*) và (**), suy ra: x = 0,2; y = 0,3.
%mFe = .
Câu 10: Hòa tan hoàn toàn 6,44 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 8,98.
B. 9,52.
C. 7,25.
D. 12,2.
Hướng dẫn giải
Đáp án đúng là: D
Sơ đồ phản ứng: X + H2SO4 Muối + H2.
= 0,06 (mol) = = 0,06 (mol).
mmuối = mX + = 6,44 + 0,06×96 = 12,2 (gam).
Câu 11. Cho 100 ml dung dịch FeCl2 1M tác dụng với 200 ml dung dịch AgNO3 4M, thu được m gam kết tủa. Giá trị của m là
A. 47,4.
B. 30,18.
C. 12,96.
D. 39,5.
Hướng dẫn giải
Đáp án đúng là: D
= 0,1 (mol) = 0,1 (mol); = 0,2 (mol).
= 0,8 (mol) = = 0,8 (mol).
Fe2+ + Ag+ Fe3+ + Ag¯ (tính theo )
0,1 0,1 0,1 (mol)
(dư) = 0,8 – 0,1 = 0,7 (mol).
Ag+ + Cl- AgCl¯ (tính theo )
0,2 0,2 0,2 (mol)
m¯ = mAg + mAgCl = 0,1×108 + 0,2×143,5 = 39,5 (gam).
Câu 12: Hoà tan a gam hỗn hợp bột Fe, Al bằng dung dịch HCl thu được 17,92 lít khí H2. Cùng lượng hỗn hợp trên hoà tan trong dung dịch NaOH dư thu được 13,44 lít khí H2. Giá trị của a là
A. 7,8.
B. 11,7.
C. 22,0.
D. 15,6.
Hướng dẫn giải
Đáp án đúng là: C
Tác dụng với dung dịch HCl: = 0,8 (mol).
Bảo toàn e: 2nFe + 3nAl = 2 2nFe + 3nAl = 1,6 (1).
Tác dụng với dung dịch NaOH: = 0,6 (mol).
Bảo toàn e: 3nAl = 2 nAl = 0,4 (mol)
Thay vào (1), suy ra: nFe = 0,2 (mol).
a = mFe + mAl = 0,2×56 + 0,4×27 = 22 (gam).
Câu 13: Cho hỗn hợp bột Al, Fe vào dung dịch chứa Cu(NO3)2 và AgNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn gồm ba kim loại là
A. Fe, Cu, Ag.
B. Al, Cu, Ag.
C. Al, Fe, Cu.
D. Al, Fe, Ag.
Hướng dẫn giải
Đáp án đúng là: A
Câu 14: Đốt nóng một hỗn hợp gồm Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ dung dịch NaOH có sinh ra H2 (đktc). Vậy X gồm
A. Al, Fe, Al2O3.
B. Fe2O3, Fe, Al2O3.
C. Al, Fe, Fe2O3.
D. Fe, Al2O3.
Hướng dẫn giải
Đáp án đúng là: A
Vì X tác dụng với dung dịch NaOH sinh ra H2 → X chứa Al dư
→ X gồm Al, Fe, Al2O3
Câu 15: Kim loại nào sau đây không tan trong dung dịch FeCl3?
A. Fe .
B. Mg.
C. Ni .
D. Ag.
Hướng dẫn giải
Đáp án đúng là: D
Cặp oxi hóa - khử Fe3+/Fe2+ đứng trước cặp oxi hóa - khử Ag+/Ag trong dãy điện hóa.
→ Theo quy tắc α thì Ag không tác dụng với dung dịch FeCl3
Câu 16: Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là
A. FeO.
B. Fe2O3.
C. Fe3O4.
D. A hoặc B.
Hướng dẫn giải
Đáp án đúng là: C
Dung dịch X vừa làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu
→ Trong dung dịch X có Fe2+ và Fe3+.
→ Oxit sắt là Fe3O4.
Phương trình phản ứng:
2Fe3+ + Cu → 2Fe2+ + Cu2+
Câu 17: Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 87,5 ml
B. 125 ml
C. 62,5 ml
D. 175 ml
Hướng dẫn giải
Đáp án đúng là: A
FeO, Fe2O3, Fe3O4 FeCl2, FeCl3 Fe2O3
= 3 : 160 = 0,01875 gam
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2 = 2.0,01875 = 0,0375 mol
→ nO = = 0,04375 mol
Bảo toàn nguyên tố O → = nO = 0,04375 mol
Bảo toàn nguyên tố H: nHCl = 2 = 2.0,04375 = 0,0875 mol
→ V = 87,5 ml.
Câu 18: Cho hỗn hợp gồm 2,8g Fe và 3,2g Cu vào dung dịch HNO3 thu được dung dịch A, V lít khí NO2 ở đktc (sản phẩm khử duy nhất) và còn dư 1,6g kim loại. Biết các phản ứng xảy ra hoàn toàn. Khối lượng muối thu được khi cô cạn dung dịch A và giá trị của V là
A. 10,6g và 2,24 lít.
B. 14,58g và 3,36 lít.
C. 16.80g và 4,48 lít.
D. 13,7g và 3,36 lít.
Hướng dẫn giải
Đáp án đúng là: D
Dư 1,6g kim loại → mCu dư = 1,6g; dung dịch A gồm: Fe(NO3)2; Cu(NO3)2
→ nCu phản ứng = 3,2 – 1,6 = 1,6 gam
→ = nCu phản ứng = = 0,025 mol
→ = 0,025.188 = 4,7 gam
= 0,05 mol
→ = 0,05.180 = 9 gam
→ m muối = 4,7 + 9 = 13,7 gam
Bảo toàn electron
→ = 2nFe + 2nCu phản ứng = 2. 0,05 + 2. 0,025 = 0,15 mol
→
Câu 19: Dung dịch A gồm 0,4 mol HCl và 0,05 mol Cu(NO3)2. Cho m gam bột Fe vào dung dịch, khuấy đều cho đến khi phản ứng kết thúc thu được chất rắn X gồm hai kim loại có khối lượng 0,8m gam. Giả sử sản phẩm khử HNO3 duy nhất chỉ có NO. Giá trị của m bằng:
A. 20 gam.
B. 30 gam.
C. 40 gam.
D. 60 gam.
Hướng dẫn giải
Đáp án đúng là: C
Sau phản ứng thu được hỗn hợp gồm 2 kim loại Fe, Cu → H+ và NO3-, Cu2+ hết.
Dung dịch chỉ chứa FeCl2: 0,2 mol (bảo toàn Cl- = 0,4 mol), Cu: 0,05 mol
→ m Fe pư = 0,2 .56 = 11,2 gam
→ 0,8m gam kim loại gồm mFe dư = m - 11,2 gam và mCu = 0,05.64 = 3,2 gam
→ 0,8m = 3,2 + m - 0,2.56 → m = 40 gam.
Câu 20: Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 cần dùng vừa đủ 2,24 lít H2 (đo ở đktc). Khối lượng Fe thu được là
A. 15 gam.
B. 17 gam.
C. 16 gam.
D. 18 gam.
Hướng dẫn giải
Đáp án đúng là: C
= nO trong oxit = 2,24 : 22,4 = 0,1 mol
mFe = m hỗn hợp - mO
→ mFe = 17,6 – 0,1.16
→ mFe = 16 gam
Câu 21: Cách nào sau đây có thể dùng để điều chế FeO?
A Dùng CO khử Fe2O3 ở 500°C.
B Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong oxi.
Hướng dẫn giải
Đáp án đúng là: A
Khử Fe2O3 bằng CO trong lò cao ở nhiệt độ khoảng 500 - 600oC thu được FeO là sản phẩm chính.
3Fe2O3 + CO 2Fe3O4 + CO2
Fe3O4 + CO 3FeO + CO2.
Câu 22: Dung dịch loãng chứa hỗn hợp 0,01 mol Fe(NO3)3 và 0,15 mol HCl có khả năng hòa tan tối đa lượng Fe là
A. 0,28 gam.
B. 1,68 gam.
C. 4,20 gam.
D. 3,64 gam.
Hướng dẫn giải
Đáp án đúng là: D
Lượng sắt phản ứng là tối đa nên sau phản ứng chỉ thu được muối sắt (II).
hết, phản ứng tính theo
nFe = 0,045 + 0,005 + 0,015 = 0,065 mol
→ mFe = 0,065.56 = 3,64 gam.
Câu 23: Có thể điều chế Fe(OH)3 bằng cách:
A. Cho Fe2O3 tác dụng với H2O .
B. Cho Fe2O3 tác dụng với NaOH vừa đủ.
C. Cho muối sắt(III) tác dụng axit mạnh.
D. Cho muối sắt(III) tác dụng dung dịch NaOH dư.
Hướng dẫn giải
Đáp án đúng là: D
Có thể điều chế Fe(OH)3 bằng cách Cho muối sắt(III) tác dụng dung dịch NaOH dư
FeCl3 + 3NaOH dư → Fe(OH)3 + 3NaCl
Câu 24: Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng một lượng dư
A. kim loại Mg.
B. kim loại Cu.
C. kim loại Ba.
D. kim loại Ag.
Hướng dẫn giải
Đáp án đúng là: B
A. Không dùng Mg vì dư Mg sẽ thu được kim loại sắt
Mg + 2Fe3+ → Mg2+ + 2Fe2+
Mg + Fe2+ → Mg2+ + Fe
B. Dùng lượng dư Cu
Cu + 2Fe3+ → Cu2+ + 2Fe2+
C. Không dùng Ba vì Ba phản ứng với nước trong dung dịch tạo hiđroxit kết tủa với Fe3+
Ba + 2H2O → Ba(OH)2 + H2
3OH- + Fe3+ → Fe(OH)3
D. Ag không khử được Fe3+
Câu 25: Hòa tan hết 4 gam hỗn hợp A gồm Fe và 1 oxit sắt trong dung dịch axit HCl (dư) thu được dung dịch X. Sục khí Cl2 cho đến dư vào X thu được dung dịch Y chứa 9,75 gam muối tan. Nếu cho 4 gam A tác dụng với dung dịch HNO3 loãng dư thì thu được V lít NO (sản phẩm khử duy nhất, đktc). Tính V?
A. 0,896
B. 0,726
C. 0,747
D. 1,120
Hướng dẫn giải
Đáp án đúng là: C
= 9,75 : 162,5 = 0,06 mol
Quy đổi hỗn hợp A về (Fe và O)
nFe = = 0,06 mol → nO = = 0,04 mol
Nếu cho A tác dụng với dung dịch HNO3. Bảo toàn electron ta có:
3nFe = 3nNO + 2nO
→ 3.0,06 = 3.nNO + 2.0,04
→ nNO = 0,033 → VNO = 0,747 lít.
Xem thêm các phương trình hóa học hay khác:
- 2Fe + 3Cl2 → 2FeCl3
- 2Fe + 3Br2 → 2FeBr3
- Fe + I2 → FeI2
- 3Fe + 2O2 → Fe3O4
- 3Fe + 2O2 → 2Fe2O3
- 2Fe + O2 → 2FeO
- Fe + S → FeS
- Fe + 2HCl → FeCl2 + H2
- Fe + 2H2SO4 → FeSO4 + H2
- Fe + H3PO4 → FeHPO4 + H2
- Fe + 2H3PO4 → Fe(H2PO4)2 + H2
- 3Fe + 2H3PO4 → Fe3(PO4)2 + 3H3
- 10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2+ 18H2O
- 8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
- Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
- 8Fe + 30HNO3 → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
- Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
- 2Fe + 4H2SO4 → Fe2(SO4)3 + S + 2H2O
- 8Fe + 15H2SO4 → 4Fe2(SO4)3 + H2S + 12H2O
- Fe + H2SO4 → FeSO4 + H2
- Fe + CuSO4 → FeSO4 + Cu
- Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
- Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
- Fe + Fe2(SO4)3 → 3FeSO4
- Fe + 2Fe(NO3)3 → 3Fe(NO3)2
- Fe + 2FeCl3 → 3FeCl2
- Fe + Cu(NO3)2 → Cu + Fe(NO3)2
- Fe + CuCl2 → Cu + FeCl2
- Fe + H2O → FeO + H2 ↑
- 3Fe + 4H2O → 4H2 ↑ + Fe3O4
- 2Fe + 3H2O2 → 2Fe(OH)3 ↓
- Fe + 8HCl + Fe3O4 → 4FeCl2 + 4H2O
- 2Fe + 3F2 → 2FeF3
- 10Fe + 6KNO3 → 5Fe2O3 + 3K2O + 3N2 ↑
- Fe + 4HCl + KNO3 → 2H2O + KCl + NO ↑ + FeCl3
- Fe + 4HCl + NaNO3→ 2H2O + NaCl + NO ↑ +FeCl3
- Fe + Fe2O3 →3FeO
- Fe + Fe3O4 → 4FeO
- Fe + HgS → FeS + Hg
- 2Fe + 3SO2 →FeSO3 + FeS2O3
- 4Fe + 5O2 + 3Si → Fe2SiO4 + 2FeSiO3
- Fe + 2HBr → H2 ↑ + FeBr2
- Fe + 2NaHSO4 → H2 ↑ + Na2SO4 + FeSO4
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



