NaHCO3 + HCl → NaCl + CO2 + H2O
Phản ứng NaHCO3 + HCl ra CO2 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về NaHCO3 có lời giải, mời các bạn đón xem:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
1. Phương trình hoá học của phản ứng NaHCO3 tác dụng với HCl
NaHCO3 + HCl → NaCl + CO2↑ + H2O
2. Điều kiện của phản ứng NaHCO3 tác dụng với HCl
- Phản ứng diễn ra ở ngay điều kiện thường.
3. Hiện tượng của phản ứng NaHCO3 tác dụng với HCl
- Có khí thoát ra.
4. Phương trình ion thu gọn của phản ứng NaHCO3 tác dụng với HCl
Bước 1: Viết phương trình phân tử:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; Các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử ta được phương trình ion đầy đủ:
Na+ + HCO3- + H+ + Cl- → Na+ + Cl- + CO2↑ + H2O
Bước 3: Lược bỏ đi các ion giống nhau ở 2 vế ta được phương trình ion rút gọn:
HCO3- + H+ → CO2↑ + H2O
5. Mở rộng kiến thức về NaHCO3 (natri bicarbonate)
5.1. Tính chất
- NaHCO3 là chất rắn, màu trắng, dễ tan trong nước.
- NaHCO3 dễ bị nhiệt phân hủy tạo thành Na2CO3 và khí CO2:
2NaHCO3 Na2CO3 + CO2 + H2O
- NaHCO3 có tính lưỡng tính (vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ)
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
5.2. Ứng dụng
NaHCO3 được dùng trong công nghiệp dược phẩm (chế tạo thuốc đau dạ dày …) và công nghiệp thực phẩm (làm bột nở …).
6. Kiến thức về hydrochloric acid HCl
6.1. Tính chất vật lí
- Hiđro clorua tan vào nước tạo thành dung dịch hydrochloric acid.
- hydrochloric acid là chất lỏng, không màu, mùi xốc.
- Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
- Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
6.2. Tính chất hóa học
Hydrochloric acid là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với basic oxide và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
6.3. Điều chế
a) Trong phòng thí nghiệm
- Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được hydrochloric acid.
- Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc NaHSO4 + HCl ↑
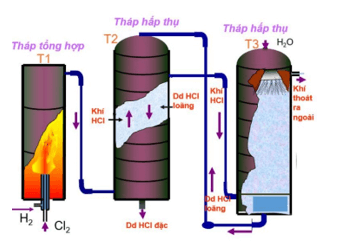
b) Trong công nghiệp
- Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 2HCl
- Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
7. Bài tập vận dụng liên quan
Câu 1:Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A.0,020.B.0,030.C.0,015.D.0,010.
Hướng dẫn giải
Đáp án D
Phản ứng xảy ra theo thứ tự sau
Phản ứng (2) NaHCO3 dư nên số mol CO2 được tính theo HCl
→ = 0,010 mol
Câu 2: Cho từ từ dung dịch chứa a mol HCl vào dung dịch X chứa b mol Na2CO3 đồng thời khuấy đều, thu dược V lít khí (đktc) và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện kết tủa. Biểu thức liên hệ giữa V với a và b là?
A. V = 22,4(a – b) B. V = 11,2(a – b)
C. V = 11,2(a + b) D. V = 22,4( a + b)
Hướng dẫn giải
Đáp án A
Phản ứng xảy ra theo thứ tự sau
Dung dịch Y phản ứng với nước vôi trong dư tạo kết tủa nên NaHCO3 dư ở phản ứng (2), HCl phản ứng hết.
2NaHCO3 + Ca(OH)2 → CaCO3↓+ Na2CO3 + H2O
→ = nHCl (2)
→ = a – b
→ V = 22,4(a – b)
Câu 3: Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần ba dung dịch A là
A. 100 ml. B. 200 ml. C. 300 ml. D. 600 ml.
Hướng dẫn giải
Đáp án A
= 0,03 mol
mol
→ VHCl = lít = 100 ml
Câu 4: Muối được dùng để chế thuốc chữa đau dạ dày do thừa axit trong dạ dày là
A. Na2CO3. B. NaHCO3. C. NH4HCO3. D. NaF.
Hướng dẫn giải
Đáp án B
Muối NaHCO3 có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2
Câu 5: Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đểu có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Hướng dẫn giải
Đáp án A
Muối Na2CO3 không bị nhiệt phân
Câu 6: Trung hoà V ml dung dịch NaOH 1M bằng 100 ml dung dịch HCl 1M. Giá trị của V là
A. 400. B. 200. C. 100. D. 300.
Hướng dẫn giải
Đáp án C
NaOH + HCl → NaCl + H2O
nNaOH = nHCl = 0,1 mol
→ VNaOH = 100 ml
Câu 7: Nung nóng 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khối lượng không thay đổi còn lại 69 gam chất rắn. Thành phần % khối lượng mỗi chất trong hỗn hợp đầu là
A. 63% và 37%. B. 16% và 84%. C. 42% và 58%. D. 21% và 79%.
Hướng dẫn giải
Đáp án B
Đặt số mol Na2CO3, NaHCO3 lần lượt là x, y mol
→ 106x + 84y= 100 gam (1)
2NaHCO3 → Na2CO3+ CO2+ H2O
ymol mol
→ = (x+).106= 69 gam (2)
Giải hệ (1) và (2) ta có x= mol; y= 1mol
→ % = 16%; % = 84%
Câu 8: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. KNO3 và BaCl2. B. NaHCO3 và KOH.
C. Na2CO3 và NaHSO4. D. Na2CO3 và CaCl2.
Hướng dẫn giải
Đáp án A
Cặp chất có các ion không phản ứng với nhau sẽ cùng tồn tại trong dung dịch
B. + OH- → CO2 + H2O
C. + 2H+ → CO2 + H2O
D. + Ca2+ → CaCO3
Câu 9: Cho 36 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00. B. 0,50. C. 0,75. D. 1,25.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
Theo PTHH: nHCl = 2nFeO = 1 mol
Câu 10. Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Hướng dẫn giải
Đáp án B
6HCl + Al2O3 → 2AlCl3 + 3H2O
0,3 → 0,05 mol
= 0,05.102 = 5,1 gam
Câu 11. Cho 5,6 gam một oxit kim loại tác dụng vừa đủ với HCl cho 11,1 gam muối clorua của kim loại đó. Cho biết công thức oxit kim loại?
A. Al2O3. B. CaO. C. CuO. D. FeO.
Hướng dẫn giải
Đáp án B
Gọi công thức oxit là M2Oa
2aHCl + M2Oa → 2MCla + aH2O
Gọi số mol H2O là x (mol)⇒ nHCl = 2x (mol)
Bảo toàn khối lượng: 36,5.2x + 5,6 = 11,1 + 18.x
⇒ x = 0,1 mol
a |
1 |
2 |
3 |
M |
20 |
40 |
60 |
Kết luận |
Loại |
Ca |
Loại |
Câu 12. Cho 30,00 gam hỗn hợp X gồm Fe và FeO phản ứng với dung dịch HCl dư, đến khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc). Khối lượng của FeO trong 30,00 gam hỗn hợp X là
A. 13,2 gam. B. 46,8 gam. C. 16,8 gam. D. 5,6 gam.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
2HCl + Fe → FeCl2 + H2
Theo PTHH:
nFe = nkhí = 0,3 mol ⇒ mFeO = 30 – 0,3.56 = 13,2 gam.
Xem thêm các phương trình hóa học hay khác:
- 2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
- Ca(OH)2 + 2NaHCO3 → K2CO3 + CaCO3 ↓ + 2H2O
- Ba(OH)2 + 2NaHCO3 → K2CO3 + BaCO3 ↓ + 2H2O
- Phản ứng nhiệt phân: 2NaHCO3 -to→ Na2CO3 +CO2 ↑ + H2O
- NaHCO3 + HBr → NaBr + CO2 ↑ + H2O
- NaHCO3 + HNO3 → NaNO3 + CO2 ↑ + H2O
- 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
- NaHCO3 + NaHSO4 → Na2SO4 + CO2 ↑ + H2O
- 2NaHCO3 + 2KHSO4 → K2SO4 + Na2SO4+ 2CO2 ↑ + 2H2O
- 2NaHCO3 + Ba(HSO4)2 → Na2SO4 + BaSO4 ↓+ 2CO2 ↑ + 2H2O
- 2NaHCO3 + Ca(HSO4)2 → Na2SO4 + CaSO4+ 2CO2 ↑ + 2H2O
- 2NaHCO3 + MgSO4 → Na2SO4 + Mg(OH)2 ↓ + 2CO2 ↑
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



