Mg(NO3)2 → MgO + NO2 ↑ + O2 ↑ | Mg(NO3)2 ra MgO | Mg(NO3)2 ra NO2 | Mg(NO3)2 ra O2
Phản ứng nhiệt phân: Mg(NO3)2 -to hay Mg(NO3)2 ra MgO hoặc Mg(NO3)2 ra NO2 hoặc Mg(NO3)2 ra O2 thuộc loại phản ứng phân hủy đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Mg(NO3)2 có lời giải, mời các bạn đón xem:
Nhiệt phân: 2Mg(NO3)2 -to→ 2MgO + 4NO2 ↑ + O2 ↑
Điều kiện phản ứng
- nhiệt độ cao.
Cách thực hiện phản ứng
- nhiệt phân Mg(NO3)2.
Hiện tượng nhận biết phản ứng
- Có khí màu nâu đỏ thoát ra, chất rắn sau phản ứng có khối lượng giảm so với ban đầu.
Bạn có biết
- Muối nitrate của các kim loại magie, kẽm, sắt, chì, đồng … bị phân hủy tạo thành oxit của kim loại tương ứng, NO2 và O2.
Ví dụ minh họa
Ví dụ 1:
Sản phẩm thu được khi nhiệt phân Mg(NO3)2 là
A. MgO, NO2, O2. C. Mg, NO2, O2.
B. Mg(NO2)2, O2. D. Mg, N2, O2.
Hướng dẫn giải:
2Mg(NO3)2 -to→ 2MgO + 4NO2 ↑ + O2 ↑
Đáp án A.
Ví dụ 2:
Thể tích khí ở dktc thoát ra khi nhiệt phân hoàn toàn 0,1 mol Mg(NO3)2 là
A. 1,12 lít. B. 5,60 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải:
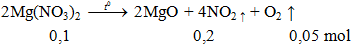
V = 0,25.22,4 = 5,6lít.
Đáp án B.
Ví dụ 3:
Khi nhiệt phân chất nào sau không thu được oxit kim loại ?
A. Mg(NO3)2. B. Cu(NO3)2. C. NaNO3. D. Zn(NO3)2.
Hướng dẫn giải:
nhiệt phân NaNO3 thu được NaNO2 và O2.
Đáp án C.
Xem thêm các phương trình hóa học hay khác:
- Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3
- Mg(NO3)2 + 2KOH → Mg(OH)2 ↓ + 2KNO3
- Mg(NO3)2 + Ba(OH)2 → Mg(OH)2 ↓ + Ba(NO3)2
- Mg(NO3)2 + Ca(OH)2 → Mg(OH)2 ↓ + Ca(NO3)2
- Mg(NO3)2 + Na2CO3 → MgCO3 ↓ + 2NaNO3
- Mg(NO3)2 + K2CO3 → MgCO3 ↓ + 2KNO3
- Mg(NO3)2 + 2NH3 + 2H2O → Mg(OH)2 ↓ + 2NH4NO3
- Mg(NO3)2 + 3Cu +8HCl → 3CuCl2 + MgCl2 + 2NO ↑ + 4H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



