Giải vở bài tập Hóa 8 Bài 32: Phản ứng oxi hóa - khử
Giải vở bài tập Hóa 8 Bài 32: Phản ứng oxi hóa - khử
Với lời giải VBT Hóa 8 Bài 32: Phản ứng oxi hóa - khử hay, chi tiết sẽ giúp học sinh lớp 8 dễ dàng trả lời câu hỏi và làm bài tập trong Vở bài tập Hóa học 8.
Học theo Sách giáo khoa
1. Sự khử. Sự oxi hóa
a) Sự khử: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao:
H2 + CuO Cu + H2O (1)
Khí H2 đã chiếm nguyên tố oxi trong CuO
Trong phản ứng (1) xảy ra quá trình tách nguyên tử oxi khỏi hợp chất CuO.
Ta nói đã xảy ra sự khử CuO tạo ra Cu.
Như vậy: Sự tách oxi khỏi hợp chất gọi là sự khử.
b) Sự oxi hóa
Sự tác dụng của oxi với một chất gọi là sự oxi hóa.
Trong phản ứng (1) xảy ra sự oxi hóa H2 tạo thành H2O.
2. Chất khử và chất oxi hóa
- H2 và C là chất khử vì là chất chiếm oxi
- CuO, O2 là chất oxi hóa vì là chất nhường oxi, bản thân oxi cũng là chất oxi hóa.
Kết luận
- Chất chiếm oxi của chất khác là chất khử
- Chất nhường oxi cho chất khác là chất oxi hóa
- Trong phản ứng của oxi với cacbon, bản thân oxi cũng là chất oxi hóa.
3. Phản ứng oxi hóa – khử
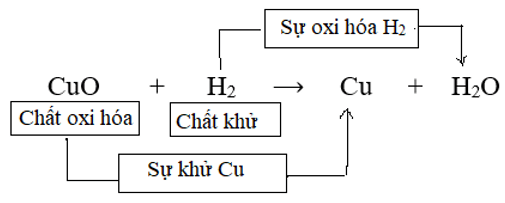
Sơ đồ biểu diễn quá trình khử và quá trình oxi hóa trong phản ứng (1):
Sự khử và sự oxi hóa là hai quá trình tuy ngược nhau nhưng xảy ra đồng thời trong cùng một phản ứng hóa học.
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
4. Tầm quan trọng của phản ứng oxi hóa - khử
Phản ứng oxi hóa - khử là phản ứng hóa học làm cơ sở của nhiều công nghệ sản xuất trong luyện kim và công nghệ hóa học. Phản ứng oxi hóa - khử làm tăng hiệu suất, nâng cao chất lượng sản phẩm.
Bài tập
Bài 1 trang 118 VBT Hóa học 8: Khoanh tròn vào câu đúng:
a. Chất nhường oxi cho chất khác là chất khử;
b. Chất nhường oxi cho chất khác là chất oxi hóa;
c. Chất chiếm oxi của chất khác là chất khử;
d. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có xảy ra sự oxi hóa;
e. Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có xảy ra đồng thời sụ oxi hóa và sự khử.
Lời giải
Các câu phát biểu đúng là b, c, e.
Những câu sai: a, d vì những câu này hiểu sai về chất khử, chất oxi hóa và phản ứng oxi hóa - khử.
Bài 2 trang 118 VBT Hóa học 8: Hãy cho biết trong những phản ứng hóa học xảy ra quanh ta sau đây, phản ứng nào là phản ứng oxi hóa – khử? Lợi ích và tác hại của mỗi phản ứng?
a) Đốt than trong lò: C + O2 CO2
b) Dùng cacbon oxit khử sắt(III) oxit trong luyện kim.
Fe2O3 + 3CO 2Fe + 3CO2.
c) Nung vôi: CaCO3 CaO + CO2.
d) Sắt bị gỉ trong không khí ẩm (phản ứng chính): 4Fe + 3O2 → 2Fe2O3.
Lời giải
Các phản ứng thuộc loại phản ứng oxi hóa khử là: a, b, d
|
Phản ứng |
Lợi ích/ Tác hại |
|
a) C + O2 CO2 |
- Tạo ra nhiệt lượng cần thiết phục vụ đời sống. - Sản phẩm CO2 gây hiệu ứng nhà kính,… |
|
b) Fe2O3 + 3CO Fe + 3CO2 |
- Thu được kim loại sắt trong công nghiệp luyện kim. - Sản phẩm CO2 gây hiệu ứng nhà kính,… |
|
c) CaCO3 CaO + CO2 |
- Sản xuất vôi sống để dùng trong công nghiệp hay xây dựng công trình dân dụng. - Sản phẩm CO2 gây hiệu ứng nhà kính,… |
|
d) 4Fe + 3O2 → 2Fe2O3 |
- Phản ứng có hại, làm gỉ sắt kim loại, các vật dụng khác. |
Bài 3 trang 118 VBT Hóa học 8: Hãy lập các phương trình hóa học theo các sơ đồ sau:
Fe2O3 + CO CO2 + Fe (1)
Fe3O4 + H2 H2O + Fe (2)
CO2 + Mg MgO + C (3)
Các phản ứng hóa học này có phải ứng oxi hóa – khử không? Vì sao? Nếu là phản ứng oxi hóa – khử, cho biết chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
Lời giải
Fe2O3 + 3CO 3CO2 + 2Fe (1)
Fe3O4 + 4H2 4H2O + 3Fe (2)
CO2 + 2Mg 2MgO + C (3)
Các phản ứng thuộc loại phản ứng oxi hóa - khử là: (1), (2), (3)
|
Phản ứng |
Chất khử |
Chất oxi hóa |
Vì sao? |
|
(1) |
CO |
Fe2O3 |
Fe2O3 nhường oxi cho CO |
|
(2) |
H2 |
Fe3O4 |
Fe3O4 nhường oxi cho H2 |
|
(3) |
Mg |
CO2 |
CO2 nhường oxi cho Mg |
Bài 4* trang 119 VBT Hóa học 8: Trong phòng thí nghiệm, người ta đã dùng cacbon oxit CO để khử 0,2 mol Fe3O4 và dùng khí hiđro để khử 0,2 mol Fe2O3 ở nhiệt độ cao.
a) Viết phương trình hóa học của các phản ứng xảy ra;
b) Tính số lít khí CO và H2 ở đktc cần dùng cho mỗi phản ứng.
c) Tính số gam sắt thu được ở mỗi phản ứng hóa học.
Lời giải
a) Phương trình hóa học của các phản ứng đã xảy ra:
Fe3O4 + 4CO 4CO2 + 3Fe (1)
Fe2O3 + 3H2 3H2O + 2Fe (2)
b) Theo phương trình (1), muốn khử 1 mol Fe3O4 cần 4 mol CO
Vậy muốn khử 0,2 mol Fe3O4 cần = 0,8 mol CO.
Thể tích khí CO (đktc) cần dùng: V = 0,8.22,4 = 17,92 (lít)
Theo phương trình (2), muốn khử 1 mol Fe2O3 cần 3 mol H2.
Vậy muốn khử 0,2 mol Fe2O3 cần = 0,6 mol H2.
Thể tích khí hiđro (đktc) cần dùng: V = 0,6.22,4 = 13,44 (lít)
c) Theo phương trình (1), khử 1 mol Fe3O4 được 3 mol Fe.
Vậy khử 0,2 mol Fe3O4 được = 0,6 mol Fe
→ khối lượng: mFe = 0,6. 56 = 33,6 gam
Theo phương trình (2), khử 1 mol Fe2O3 được 2 mol Fe
Vậy khử 0,2 mol Fe2O3 được = 0,4 mol Fe
→ khối lượng: mFe = 0,4. 56 = 22,4 gam
Bài 5* trang 119 VBT Hóa học 8: Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2 gam sắt.
a) Viết phương trình hóa học của các phản ứng đã xảy ra;
b) Tính khối lượng sắt (III) oxit đã phản ứng;
c) Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
Lời giải
a) Phương trình phản ứng hóa học:
Fe2O3 + 3H2 3H2O + 2Fe
b) Số mol sắt thu được: nFe = 11,2/56 = 0,2 (mol).
Theo phương trình, để thu được 2 mol Fe cần 1 mol Fe2O3
Vậy để thu được 0,2 mol Fe cần 0,1 mol Fe2O3
Khối lượng Fe2O3 tham gia phản ứng: m = 0,1.160 = 16 gam
c) Theo phương trình phản ứng, để thu được 2 mol Fe cần 3 mol H2
Vậy để thu được 0,2 mol Fe cần 0,3 mol H2
Thể tích khí hiđro đã tiêu thụ: V = 22,4.0,3 = 6,72 (lít).
Bài tập trong sách bài tập
Bài 32.4 trang 120 VBT Hóa học 8: Cho các loại phản ứng hoá học sau:
(1) Phản ứng hoá hợp ; (2) Phản ứng phân huỷ ; (3) Phản ứng oxi hoá - khử.
Những biến đổi hoá học sau đây thuộc loại phản ứng nào ?
a) Nung nóng canxi cacbonat.
b) Sắt tác dụng với lưu huỳnh.
c) Khí CO đi qua chì (II) oxit nung nóng.
Lời giải
a) Nung nóng canxi cacbonat: Thuộc loại phản ứng (2).
b) Sắt tác dụng với lưu huỳnh: Thuộc loại phản ứng (1), (3).
Mở rộng: Phản ứng oxi hóa – khử còn được định nghĩa là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng. (sẽ học ở các lớp trên)
c) Khí CO đi qua chì (II) oxit: Thuộc loại phản ứng (3).
Bài 32.7 trang 120 VBT Hóa học 8: Dẫn luồng khí H2 dư đi qua 16g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp đầu.
Lời giải
Đặt số mol CuO và Fe2O3 lần lượt là x và y
Phương trình hóa học của các phản ứng:
Tính khối lượng hỗn hợp sau phản ứng theo x, y:
mhh = 64x + 112y
Khối lượng hỗn hợp giảm 25% nghĩa là:
16 – (64x + 112y) = 16.25%
⟶ 16x + 28y = 3
Tính x và y
Giải hệ ta được: x = 0,1 và y = 0,05
Tính khối lượng mỗi oxit:
mCuO = 0,1.80 = 8 gam
= 0,05.160 = 8 gam
Tính tỉ lệ % mỗi oxit: %mCuO = % = .100% = 50%
Bài 32.11 trang 121 VBT Hóa học 8: Người ta điều chế được 24g đồng bằng cách dùng hiđro khử đồng (II) oxit.
a) Khối lượng đồng (II) oxit bị khử là
A. 15 g. B. 45 g. C. 60 g. D. 30 g.
b) Thể tích khí hiđro (đktc) đã dùng là
A. 8,4 lít. B. 12,6 lít. C. 4,2 lít. D. 16,8 lít.
Lời giải
a) Chọn D
Tính số mol Cu: nCu = 24/64 = 0,375 mol
Phương trình hóa học:
→ x = 0,375 mol; y = 0,375 mol
Khối lượng CuO bị khử là: 0,375 . 80 = 30 gam
b) Chọn A
Tính thể tích khí hiđro đã dùng (đktc): lít
Xem thêm các bài Giải Vở bài tập Hóa học 8 hay khác:
- VBT Hóa 8 Bài 33: Điều chế khí hiđro - Phản ứng thế
- VBT Hóa 8 Bài 34: Bài luyện tập 6
- VBT Hóa 8 Bài 36: Nước
- VBT Hóa 8 Bài 37: Axit. Bazơ. Muối
- VBT Hóa 8 Bài 38: Bài luyện tập 7
Xem thêm các loạt bài Để học tốt Hóa học lớp 8 hay khác:
- Giải bài tập Hóa học 8
- Video Giải bài tập Hóa 8
- Giải sách bài tập Hóa 8
- Lý thuyết & 400 Bài tập Hóa học 8 (có đáp án)
- Top 70 Đề thi Hóa học 8 có đáp án
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải vở bài tập Hóa học 8 hay, chi tiết của chúng tôi được biên soạn bám sát nội dung sách Vở bài tập Hóa học lớp 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều

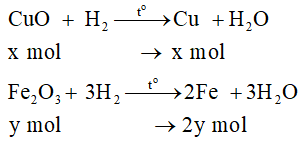
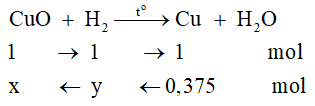



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

