Giải vở bài tập Hóa 8 Bài 33: Điều chế khí hiđro - Phản ứng thế
Giải vở bài tập Hóa 8 Bài 33: Điều chế khí hiđro - Phản ứng thế
Với lời giải VBT Hóa 8 Bài 33: Điều chế khí hiđro - Phản ứng thế hay, chi tiết sẽ giúp học sinh lớp 8 dễ dàng trả lời câu hỏi và làm bài tập trong Vở bài tập Hóa học 8.
Học theo Sách giáo khoa
I. Điều chế khí hiđro
1. Trong phòng thí nghiệm:
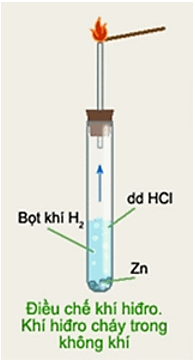
HS vẽ hình mô tả thí nghiệm dùng ống nghiệm điều chế hiđro và đốt cháy khí hiđro trong không khí và nhận xét hiện tượng:
- Có các bọt khí xuất hiện trên bề mặt mảnh kẽm rồi thoát ra khỏi lòng chất lỏng, mảnh kẽm tan dần.
- Đưa que đóm còn tàn đỏ vào đầu ống dẫn khí, khí thoát ra không làm cho than hồng bùng cháy.
- Đưa que đóm đang cháy vào đầu ống dẫn khí, khí thoát ra sẽ cháy được trong không khí với ngọn lửa màu xanh nhạt, đó là khí hiđro.
- Cô cạn một giọt dung dịch, sẽ được chất rắn màu trắng đó là ZnCl2.
Phản ứng hóa học xảy ra: Zn + 2HCl → ZnCl2 + H2↑
Trong phòng thí nghiệm, điều chế hiđro bằng cách cho kim loại kẽm (hoặc sắt, nhôm) tác dụng với dung dịch HCl, H2SO4 loãng.
Thu khí H2 vào ống nghiệm bằng cách đẩy không khí hoặc đẩy nước
Nhận ra H2 bằng cách đốt bằng que đóm đang cháy
2. Trong công nghiệp. Điều chế H2 trong công nghiệp bằng cách:
Điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí tự nhiên, khí dầu mỏ.
II. Phản ứng thế là gì?
Trong hai phản ứng:
Zn + 2HCl → ZnCl2 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
Nguyên tử của đơn chất Zn và Fe đã thay thế nguyên tử hiđro của HCl và H2SO4.
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Bài tập
Bài 1 trang 123 VBT Hóa học 8: Những phương trình hóa học nào dưới đây có thể dùng để điều chế hiđro trong phòng thí nghiệm?
a. Zn + H2SO4 → ZnSO4 + H2↑
b. 2H2O 2H2↑ + O2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
Lời giải
Những phản ứng được dùng để điều chế hiđro trong phòng thí nghiệm:
a. Zn + H2SO4 → ZnSO4 + H2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
Bài 2 trang 123 VBT Hóa học 8: Lập phương trình hóa học của phản ứng sau đây và cho biết chúng thuộc loại phản ứng hóa học nào?
a. Mg + O2 → MgO
b. KMnO4 K2MnO4 + MnO2 + O2
c. Fe + CuCl2 → FeCl2 + Cu
Lời giải
|
Phản ứng |
Thuộc loại |
|
a. 2Mg + O2 → 2MgO |
Phản ứng hóa hợp |
|
b. 2KMnO4 K2MnO4 + MnO2 + O2↑ |
Phản ứng phân hủy |
|
c. Fe + CuCl2 → FeCl2 + Cu↓ |
Phản ứng thế |
Bài 3 trang 123 VBT Hóa học 8: Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hiđro, có làm như thế được không? Vì sao?
Lời giải
Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì khí oxi nặng hơn không khí.
Đối với khí hiđro thì không thể được vì khí hiđro rất nhẹ so với không khí. Đối với khí H2 thì phải đặt ống nghiệm thẳng đứng và miệng ống nghiệm hướng xuống dưới.
Bài 4* trang 123 VBT Hóa học 8: Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng:
a. Viết phương trình hóa học có thể điều chế hiđro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để điều chế được 2,24 lít khí hiđro (ở đktc)?
Lời giải
a. Các phản ứng hóa học có thể điều chế hiđro:
Zn + 2HCl → ZnCl2 + H2 ↑ (1)
Zn + H2SO4 → ZnSO4 + H2 ↑ (2)
Fe + H2SO4 (loãng) → FeSO4 + H2↑ (3)
Fe + 2HCl → FeCl2 + H2 ↑ (4)
b. Số mol H2 cần điều chế là:
Theo phương trình, để có 0,1 mol H2 cần 0,1 mol Zn
Khối lượng kẽm cần dùng là: mZn = 0,1.65 = 6,5 (g)
Theo phương trình, để có 0,1 mol H2 cần 0,1 mol Fe
Khối lượng sắt cần dùng là: mFe = 0,1.56 = 5,6 (g).
Bài 5 trang 123 VBT Hóa học 8: Cho 22,4 g sắt tác dụng với dung dịch loãng có chứa 24,5 g axit sunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được ở đktc.
Lời giải
a) Phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 ↑
Số mol Fe: nFe = = 0,4 mol. Số mol H2SO4:
Theo phương trình, cứ 1 mol sắt tác dụng với 1 mol H2SO4.
Vậy ở đây sẽ có 0,25 mol sắt tác dụng với 0,25 mol H2SO4.
Chất còn dư là Fe (số mol: 0,15mol; khối lượng: 0,15.56 = 8,4g)
b) Số mol H2 thu được là: = nFe = 0,25 mol
Thể tích H2 (đktc): = 0,25.22,4 = 5,6 lít
Bài tập trong sách bài tập
Bài 33.1 trang 124 VBT Hóa học 8: Cho các phản ứng hoá học sau:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
(2) Na2O + H2O → 2NaOH
(3) Fe + 2HCl → FeCl2 + H2 ↑
(4) CuO + 2HCl → CuCl2 + H2O
(5) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑
(6) Mg + CuCl2 → MgCl2 + Cu ↓
(7) CaO + CO2 → CaCO3
(8) HCl + NaOH → NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 3. B. 4. C. 5. D. 6.
Lời giải
Chọn B
Đó là các phản ứng (1), (3), (5), (6).
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Bài 33.5* trang 124 VBT Hóa học 8: Trong phòng thí nghiệm có các kim loại kẽm và magie, các dung dịch axit sunfuric loãng H2SO4 và axit clohiđric HCl.
a) Hãy viết các phương trình hoá học của phản ứng để điều chế khí H2.
b) Muốn điều chế được 1,12 lít khí hiđro (đktc) phải dùng kim loại nào, axit nào để chỉ cần một khối lượng nhỏ nhất ?
Lời giải
a) Phương trình hoá học của phản ứng điều chế H2:
Zn + 2HCl → ZnCl2 + H2↑ (1)
Zn + H2SO4 → ZnSO4 + H2↑ (2)
Mg + 2HCl → MgCl2 + H2↑ (3)
Mg + H2SO4 → MgSO4 + H2↑ (4)
b) Xác định phản ứng điều chế hiđro dùng khối lượng kim loại và axit nhỏ nhất:
Muốn điều chế 1,12 lít khí hiđro với khối lượng kim loại và axit nhỏ nhất cần phải dùng kim loại magie và axit clohiđric. Theo các phương trình hoá học trên thì khối lượng nguyên tử Mg nhỏ hơn khối lượng nguyên tử Zn. Khối lượng phân tử axit HCl nhỏ hơn khối lượng phân tử axit H2SO4.
Bài 33.11 trang 125 VBT Hóa học 8: Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là
A. 1244,4 lít và 622,2 lít. B. 3733,2 lít và 1866,6 lít.
C. 4977,6 lít và 2488,8 lít. D. 2488,8 lít và 1244,4 lít.
Lời giải
Chọn D
Phương trình hóa học của phản ứng điện phân nước:
2H2O 2H2↑ + O2↑
Tính số mol oxi:
Tính số mol hiđro:
Tính thể tích oxi: lít
Tính thể tích hiđro: lít
Bài 33.12 trang 125 VBT Hóa học 8: So sánh thể tích khí hiđro (đktc) thu được trong mỗi trường hợp sau:
a) 0,1 mol Zn tác dụng với dung dịch H2SO4 loãng, dư.
0,1 mol Al tác dụng với dung dịch H2SO4 loãng, dư.
b) 0,2 mol Zn tác dụng với dung dịch HCl dư.
0,2 mol Al tác dụng với dung dịch HCl dư.
Lời giải
a) Phản ứng Zn tác dụng với dung dịch H2SO4 loãng, dư:
Số mol hiđro sinh ra:
Phản ứng Al tác dụng với dung dịch H2SO4 loãng, dư:
Số mol hiđro sinh ra:
So sánh: 0,15 > 0,1 (mol)
b) Phản ứng Zn tác dụng với dung dịch HCl loãng, dư:
Số mol hiđro sinh ra:
Phản ứng Al tác dụng với dung dịch HCl loãng, dư:
Số mol hiđro sinh ra:
So sánh: 0,3 > 0,2 (mol)
Xem thêm các bài Giải Vở bài tập Hóa học 8 hay khác:
- VBT Hóa 8 Bài 34: Bài luyện tập 6
- VBT Hóa 8 Bài 36: Nước
- VBT Hóa 8 Bài 37: Axit. Bazơ. Muối
- VBT Hóa 8 Bài 38: Bài luyện tập 7
- VBT Hóa 8 Bài 40: Dung dịch
Xem thêm các loạt bài Để học tốt Hóa học lớp 8 hay khác:
- Giải bài tập Hóa học 8
- Video Giải bài tập Hóa 8
- Giải sách bài tập Hóa 8
- Lý thuyết & 400 Bài tập Hóa học 8 (có đáp án)
- Top 70 Đề thi Hóa học 8 có đáp án
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải vở bài tập Hóa học 8 hay, chi tiết của chúng tôi được biên soạn bám sát nội dung sách Vở bài tập Hóa học lớp 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều

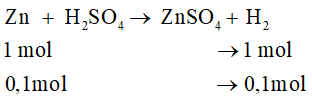
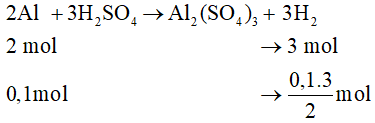
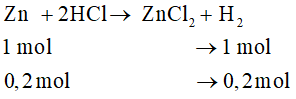
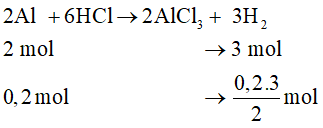



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

