Giải vở bài tập Hóa 8 Bài 38: Bài luyện tập 7
Giải vở bài tập Hóa 8 Bài 38: Bài luyện tập 7
Với lời giải VBT Hóa 8 Bài 38: Bài luyện tập 7 hay, chi tiết sẽ giúp học sinh lớp 8 dễ dàng trả lời câu hỏi và làm bài tập trong Vở bài tập Hóa học 8.
Học theo Sách giáo khoa
I. Kiến thức cần nhớ
1. Thành phần hóa học định tính của nước: gồm hiđro và oxi
Thành phần định lượng: 1 phần H và 8 phần O
2. Nước tác dụng với:
- Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca…) tạo thành bazơ tan và hiđro;
- Tác dụng với một số oxit bazơ tạo thành bazơ tan như NaOH, KOH, Ca(OH)2;
- Tác dụng với một số oxit axit tạo ra axit như H2SO4, H2SO3.
3. Phân tử axit gồm có 1 hay nhiều nguyên tử hiđro liên kết với gốc axit.
Công thức hóa học của axit gồm H và gốc axit.
4. Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (– OH).
Công thức hóa học của bazơ gồm 1 nguyên tử kim loại và một số nhóm OH.
Tên bazơ = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị ) + hiđroxit
5. Phân tử muối gồm có nguyên tử kim loại liên kết với một hay nhiều gốc axit.
Công thức hóa học của muối gồm kim loại và gốc axit.
Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị ) + tên gốc axit.
Bài tập
Bài 1 trang 143 VBT Hóa học 8: Tương tự như natri, các kim loại kali K và canxi Ca cũng tác dụng được với nước tạo thành bazơ tan và giải phóng hiđro.
a) Hãy viết phương trình hóa học xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào?
Lời giải
a) Các phương trình hóa học:
2K + 2H2O → 2KOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
b) Phản ứng hóa học trên thuộc loại phản ứng thế.
Bài 2 trang 144 VBT Hóa học 8: Hãy lập phương trình hóa học của phản ứng có sơ đồ sau đây:
a) Na2O + H2O → NaOH
K2O + H2O → KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → HNO3
c) NaOH + HCl → NaCl + H2O
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
d) Chỉ ra sản phẩm ở a), b), c) thuộc loại hợp chất nào? Nguyên nhân dẫn đến sự khác nhau về loại hợp chất của các sản phẩm ở đây a) và b)?
e) Gọi tên các chất sản phẩm.
Lời giải
a) Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
b) SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
c) NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
d) Loại chất tạo ra ở câu a): bazơ (kiềm)
Loại chất tạo ra ở câu b): axit
Loại chất tạo ra ở câu c): muối
Nguyên nhân dẫn đến sự khác nhau về loại chất của các sản phẩm ở a) và b): oxit của kim loại Na2O, K2O tác dụng với nước tạo thành bazơ, còn oxit của phi kim SO2, SO3, N2O5 tác dụng với nước tạo thành axit.
e) Gọi tên các chất sản phẩm:
NaOH: natri hiđroxit
KOH: kali hiđroxit
H2SO3: axit sunfurơ
H2SO4: axit sunfuric
HNO3: axit nitric
NaCl: natri clorua
Al2(SO4)3: nhôm sunfat
Bài 3 trang 144 VBT Hóa học 8: Viết công thức hóa học của những muối có tên gọi dưới đây:
Đồng (II) clorua, kẽm sunfat, sắt (III) sunfat, magie hiđrocacbonat, canxi photphat, natri hiđrophotphat, natri đihiđrophotphat.
Lời giải
|
Tên chất |
Công thức |
|
Đồng (II) clorua |
CuCl2 |
|
Kẽm sunfat |
ZnSO4 |
|
Sắt (III) sunfat |
Fe2(SO4)3 |
|
Magie hiđrocacbonat |
Mg(HCO3)2 |
|
Canxi photphat |
Ca3(PO4)2 |
|
Natri hiđrophotphat |
Na2HPO4 |
|
Natri đihiđrophotphat |
NaH2PO4 |
Bài 4 trang 144 VBT Hóa học 8: Cho biết khối lượng mol của một oxit của kim loại là 160 g/mol, thành phần về khối lượng của kim loại trong oxit đó là 70%. Lập công thức hóa học của oxit. Gọi tên oxit đó.
Lời giải
Đặt công thức hóa học của oxit kim loại là MxOy, nguyên tử khối của kim loại M là A.
Khối lượng của kim loại trong 1 mol oxit:
Khối lượng oxi trong 1 mol oxit: mO = 160 – 112 = 48
Ta có: 16.y = 48 → y = 3
A.x = 112 → x = 2; A = 56
Vậy kim loại M là sắt.
Bài 5 trang 145 VBT Hóa học 8: Nhôm oxit tác dụng với axit sunfuric theo phương trình hóa học như sau:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính khối lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49 gam axit sunfuric nguyên chất tác dụng với 60 gam nhôm oxit. Sau phản ứng, chất nào còn dư? Khối lượng dư của chất đó là bao nhiêu?
Lời giải
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Số mol H2SO4:
Số mol Al2O3:
Theo phương trình, cứ 1 mol Al2O3 tác dụng với 3 mol H2SO4.
Vậy sẽ có 0,5/3 ≈ 0,17 mol Al2O3 tác dụng với 0,5 mol H2SO4.
Chất còn dư là: Al2O3, số mol: 0,59 – 0,17 = 0,42 mol
Khối lượng chất còn dư là: 0,42.102 = 43 gam
Bài tập trong sách bài tập
Bài 38.2 trang 145 VBT Hóa học 8: Có những cụm từ : Sự cháy, phản ứng phân huỷ, phản ứng hoá hợp, phản ứng toả nhiệt. Hãy chọn những cụm từ thích hợp để điền vào những chỗ trống trong các câu sau:
a) ............là phản ứng hoá học, trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
b) .............là phản ứng hoá học có sinh nhiệt trong quá trình xảy ra.
c) ............là phản ứng hoá học trong đó từ một chất sinh ra nhiều chất mới.
d) ............ là sự oxi hoá có toả nhiệt và phát sáng.
Đối với mỗi câu trên hãy dẫn ra một phương trình hoá học để minh hoạ.
Lời giải
a) Phản ứng hoá hợp là phản ứng hoá học, trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Thí dụ: 2Cu + O2 2CuO
b) Phản ứng toả nhiệt là phản ứng hoá học có sinh nhiệt trong quá trình xảy ra.
Thí dụ: Phản ứng đốt cháy xăng, dầu, khí gas.
c) Phản ứng phân huỷ là phản ứng hoá học trong đó từ một chất sinh ra nhiều chất mới.
Thí dụ: 2HgO 2Hg + O2↑
d) Sự cháy là sự oxi hoá có toả nhiệt và phát sáng.
Bài 38.6 trang 146 VBT Hóa học 8: Khử 50g hỗn hợp đồng (II) oxit và sắt (II) oxit bằng khí hiđro. Tính thể tích khí hiđro cần dùng, biết rằng trong hỗn hợp, đồng (II) oxit chiếm 20% về khối lượng. Các phản ứng đó thuộc loại phản ứng gì?
Lời giải
Tính MCuO = 64 + 16 = 80
Tính MFeO = 56 + 16 = 72
Tính khối lượng đồng (II) oxit:
Tính số mol đồng (II) oxit:
Tính khối lượng sắt (II) oxit: nFeO = mhh – mCuO= 50 – 10 = 40 gam
Tính số mol sắt (II) oxit: nFeO = 40/72 = 5/9 mol
Phương trình hóa học:
Phản ứng của đồng (II) oxit với hiđro:
Phản ứng của sắt (II) oxit với hiđro:
Tổng số mol hiđro cần dùng: 0,125 + 5/9 = 49/72 mol
Tổng thể tích khí hiđro cần dùng là: (49/72). 22,4 ≈ 15,24 lít
Các phản ứng trên thuộc loại phản ứng oxi hóa - khử.
Bài 38.8 trang 146 VBT Hóa học 8: Trong phòng thí nghiệm có các kim loại Al, Fe và dung dịch HCl.
a) Cho cùng một khối lượng các kim loại trên tác dụng hết với dung dịch HCl thì kim loại nào cho khí hiđro nhiều hơn ?
b) Nếu thu được cùng một lượng khí hiđro thì khối lượng kim loại nào dùng ít hơn?
Lời giải
Gọi khối lượng của các kim loại cùng tác dụng với dung dịch HCl là a.
a) Phương trình hóa học của phản ứng Al và dung dịch HCl:
Số mol H2 thu được:
Phương trình hóa học của phản ứng Fe và dung dịch HCl:
Số mol H2 thu được:
Kết luận: Vậy cùng một lượng Al và Fe tác dụng hết với dung dịch HCl thì nhôm cho thể tích hiđro nhiều hơn sắt.
b) Nếu thu được cùng một lượng khí hiđro thì lượng nhôm dùng ít hơn lượng sắt.
Bài 38.11 trang 147 VBT Hóa học 8:
a) Cho 13g kẽm tác dụng với 0,3 mol HCl, khối lượng muối ZnCl2 được tạo thành trong phản ứng này là
A. 20,4g. B. 10,2g.
C. 30,6g. D. 40g
b) Có thể nói trong HCl có các đơn chất hiđro và clo được không?
Lời giải
a) Tính số mol kẽm: nZn = 13/65 = 0,2 mol
- Phương trình hoá học (với số mol các chất):
Chất đã tác dụng hết: HCl
Chất còn dư: Zn
Tính khối lượng ZnCl2 theo chất đã tác dụng hết:
= 0,15.136 = 20,4g
b) Không thể nói trong HCl có các đơn chất hiđro và clo, vì theo định nghĩa hợp chất do từ hai nguyên tố hoá học cấu tạo nên. Do đó chỉ có thể nói trong HCl có các nguyên tố hiđro và clo.
Bài 38.24 trang 148 VBT Hóa học 8: Dùng khí H2 khử 31,2g hỗn hợp CuO và Fe3O4, trong hỗn hợp khối lượng Fe3O4 nhiều hơn khối lượng CuO 15,2g. Tính khối lượng Cu và Fe thu được.
Lời giải
Gọi a là khối lượng của CuO.
Tính khối lượng của hỗn hợp theo a:
Khối lượng của Fe3O4 là a + 15,2 (gam)
Tính a: → 31,2 = a + a + 15,2 → a = 8 gam
Tính khối lượng CuO: mCuO = a = 8 gam
Tính khối lượng Fe3O4: moxit sắt = a + 15,2 = 23,2 gam
Tính số mol CuO: 8/80 = 0,1 mol
Tính số mol Fe3O4: 23,2/232 = 0,1 mol
Phương trình hóa học của phản ứng H2 với CuO:
Tính khối lượng Cu: mCu = 0,1.64 = 6,4 gam
Phương trình hóa học của phản ứng H2 với Fe3O4:
Tính khối lượng Fe: mFe = 0,3.56 = 16,8 gam
Xem thêm các bài Giải Vở bài tập Hóa học 8 hay khác:
- VBT Hóa 8 Bài 40: Dung dịch
- VBT Hóa 8 Bài 41: Độ tan của một chất trong nước
- VBT Hóa 8 Bài 42: Nồng độ dung dịch
- VBT Hóa 8 Bài 43: Pha chế dung dịch
- VBT Hóa 8 Bài 44: Bài luyện tập 8
Xem thêm các loạt bài Để học tốt Hóa học lớp 8 hay khác:
- Giải bài tập Hóa học 8
- Video Giải bài tập Hóa 8
- Giải sách bài tập Hóa 8
- Lý thuyết & 400 Bài tập Hóa học 8 (có đáp án)
- Top 70 Đề thi Hóa học 8 có đáp án
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải vở bài tập Hóa học 8 hay, chi tiết của chúng tôi được biên soạn bám sát nội dung sách Vở bài tập Hóa học lớp 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều

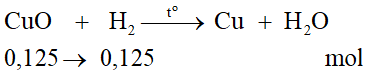
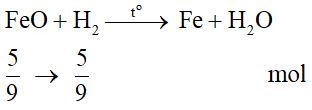
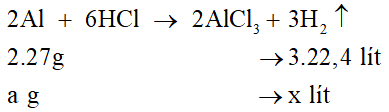
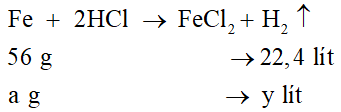
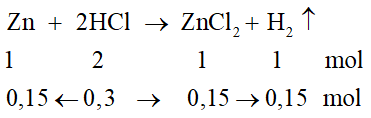
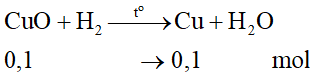
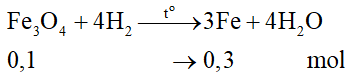



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

