Giáo án Hóa học 11 Chân trời sáng tạo Bài 4: Ammonia và một số hợp chất ammonium
Giáo án Hóa học 11 Chân trời sáng tạo Bài 4: Ammonia và một số hợp chất ammonium
Chỉ từ 200k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 11 Chân trời sáng tạo (cả năm) bản word chuẩn kiến thức, trình bày đẹp mắt:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. MỤC TIÊU
1. Kiến thức:
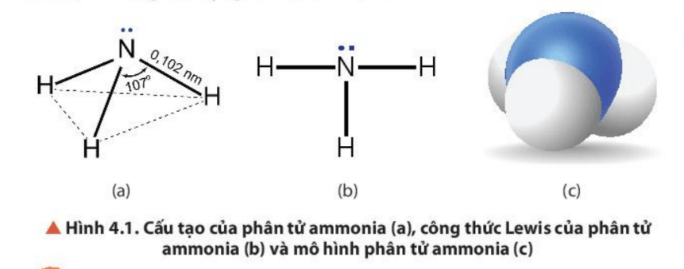
- Mô tả được công thức Lewis và hình học của phân tử ammonia.
- Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hóa học (tính base, tính khử). Viết được phương trình hóa học minh họa.
- Vận dụng được kiến thức về cân bằng hóa học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành ammonia trong kiềm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch.
- Trình bày được ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- Thực hiện được hoặc quan sát video thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ammonium.
2. Năng lực:
* Năng lực chung:
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình ảnh về mô hình nguyên tử để tìm hiểu về thành phần nguyên tử.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về các hạt cấu tạo nên nguyên tử, thành phần của nguyên tử, khối lượng nguyên tử.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao khối lượng nguyên tử được coi gần đúng là khối lượng của hạt nhân nguyên tử?
* Năng lực hóa học:
a. Nhận thức hoá học:
- Mô tả được công thức Lewis và hình học của phân tử ammonia.
- Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hóa học (tính base, tính khử). Viết được phương trình hóa học minh họa.
- Vận dụng được kiến thức về cân bằng hóa học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành ammonia trong kiềm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch.
- Trình bày được ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- Thực hiện được hoặc quan sát video thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ammonium.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động: Thảo luận, tìm tòi qua các video về quá trình Haber và tầm quan trọng trong sự phát triển nông nghiệp.
c. Vận dụng kiến thức, kĩ năng đã học tìm hiểu máy làm lạnh bằng ammonia.
3. Phẩm chất:
- Chăm chỉ, tự tìm tòi thông tin trong SGK, qua internet về phân tử ammonia, quá trình tổng hợp ammonia, ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hình ảnh, video về công thức Lewis và hình học của phân tử ammonia. Video minh họa tính chất vật lý, tính chất hóa học của ammonia, quá trình Haber. Hình ảnh và video về tính chất vật lí và tính chất hóa học của muối ammonium. Hình ảnh ứng dụng của ammonia và muối ammonium.
- Phiếu bài tập
III. TIẾN TRÌNH DẠY HỌC:
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra kiến thức cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động
a) Mục tiêu:
- Huy động các kiến thức đã được học của HS về kiến thức thực tế, số oxi hóa của nitrogen, màu chỉ thị theo môi trường, tạo nhu cầu tiếp tục tìm hiểu kiến thức mới.
- Tìm hiểu về lịch sử của NH3.
b) Nội dung:
- GV nêu câu hỏi, HS trả lời nhanh 4 câu hỏi để mở ra bức tranh hóa học về mô hình phân tử NH3
Câu 1: Trong nước tiểu thường có mùi gì?
Câu 2: Số oxi hóa thấp nhất của nguyên tố nitrogen?
Câu 3: Trong môi trường base thì phenophthalein có màu gì?
Câu 4: Sản phẩm nào được sinh ra từ phản ứng giữa N2 và H2?
- Từ câu trả lời của HS giáo viên giới thiệu lịch sử NH3.
c) Sản phẩm:
Câu 1: Trong nước tiểu thường có mùi khai.
Câu 2: Số oxi hóa thấp nhất của nguyên tố nitrogen là -3.
Câu 3: Trong môi trường base thì phenophthalein có màu hồng.
Câu 4: Sản phẩm nào được sinh ra từ phản ứng giữa N2 và H2 là NH3
- “Con đường hóa học” Người đầu tiên điều chế ra ammonia nguyên chất là nhà hóa học người Anh Josheph Priestley. Ông đã thực hiện thành công thí nghiệm của mình vào năm 1774. Tên gọi ammonia xuất phát từ những người tôn thờ thần Amun của Ai Cập – các Ammonians, bởi vì họ sử dụng amonium chloride (còn gọi là muối bay hơi) được tạo một cách tự nhiên trong các vết nứt gần núi lửa, và khi đun nóng nó phân hủy thành ammonia. Trong không khí có một lượng ammonia không đáng kể sinh ra do quá trình phân hủy của động vật, thực vật.
d) Tổ chức thực hiện: HS làm việc theo bàn, GV gợi ý, hỗ trợ HS.
2. Hoạt động 2: Hình thành kiến thức mới
|
Hoạt động 1: Cấu tạo của phân tử ammonia Mục tiêu: HS tìm hiểu cấu tạo phân tử ammonia. | |
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|
Giao nhiệm vụ học tập: GV chia lớp làm 4 nhóm, hoàn thành phiếu bài tập sau: PHIẾU HỌC TẬP SỐ 1 Câu 1: Viết công thức phân tử, công thức electron và CTCT của ammonia: a/ Công thức phân tử của ammonia: b/ Công thức electron của ammonia: c/ CTCT của ammonia của ammonia: Câu 2: Cho biết liên kết giữa N và H thuộc loại liên kết gì? Câu 3: Xác định số oxi hóa của N trong phân tử ammonia. Câu 4: Dự đoán tính tan trong nước và tính oxi hóa – khử của ammonia. Giải thích? Thực hiện nhiệm vụ: HS hoàn thành phiếu bài tập theo 4 nhóm. Báo cáo, thảo luận: Đại diện nhóm HS đưa ra nội dung kết quả thảo luận của nhóm. Kết luận, nhận định: GV nhận xét, đưa ra kết luận: - Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen. - NH3 có tính khử - Phân tử NH3 là phân tử phân cực nên tan tốt trong dung môi phân cực là H2O. |
1. Cấu tạo phân tử Ammonia - Trong phân tử NH3, nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực, ở nguyên tử N còn một cặp electron chưa liên kết. => Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen. - N có số oxh là -3 => NH3 có tính khử - Phân tử NH3 là phân tử phân cực nên tan tốt trong dung môi phân cực là H2O. |
|
Hoạt động 2: Tính chất của ammonia Mục tiêu: HS tìm hiểu tính chất vật lý và tính chất hóa học của ammonia. | |
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|
Giao nhiệm vụ học tập: - GV cho HS xem video NH3 tan vào nước cho biết trạng thái, màu, tính tan và video tính chất hóa của NH3 cho biết tính chất hóa học của NH3. - HS hoàn thành PHIẾU HỌC TẬP SỐ 2. PHIẾU HỌC TẬP SỐ 2 Câu 1: Em hãy nêu tính chất vật lý của NH3: - Trạng thái, màu sắc, mùi vị: - Tỉ khối so với không khí: - Độ tan trong nước: Câu 2: Tại sao không thu khí ammonia bằng phương pháp đẩy nước. Câu 3: Vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình) Thực hiện nhiệm vụ: HS hoàn thành phiếu bài tập theo 4 nhóm. Báo cáo, thảo luận: Đại diện nhóm HS đưa ra nội dung kết quả thảo luận của nhóm. Kết luận, nhận định: GV nhận xét, đưa ra kết luận: - Ammonia là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí - Tan nhiều trong nước, tạo thành dd ammonia - Không thể thu khí NH3 theo phương pháp đẩy nước do NH3 tan nhiều trong nước. - Thu khí NH3 tạo ra bằng cách đẩy không khí ra khỏi ống úp ngược vì NH3 nhẹ hơn không khí. - HS được xem những video thí nghiệm (TN) minh họa tính chất của ammonia trên màn hình máy tính hoặc ti vi, sau đó hoàn thành các nội dung trên phiếu học tập. HS tự nêu lên hiện tượng quan sát được và giải thích. + HĐ nhóm: GV tổ chức hoạt động nhóm ở phiếu học tập số 3, tập trung vào việc giải thích tại sao ammonia có tính base yếu và tính khử. + HĐ chung cả lớp: Các nhóm báo cáo kết quả và phản biện cho nhau. GV chốt lại kiến thức. Kết luận, nhận định: GV nhận xét, đưa ra kết luận: Ammonia có các tính chất hoá học cơ bản: - Tính base yếu - Tính khử |
2. Tính chất của ammonia a, Tính chất vật lý của ammonia. - Ammonia là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí - Tan nhiều trong nước, tạo thành dd ammonia. Dung dịch ammonia đậm đặc thường có nồng độ 25%. b, Tính chất hóa học của ammonia. Tác dụng với nước: Khi hòa tan khí NH3 vào nước một phần nhỏ các phân tử NH3 phản ứng. NH3 + H2O ⇌ NH4+ + OH- => là một base yếu. Dùng quỳ tím ẩm để nhận biết khí NH3 → xanh. Tác dụng với axit: tạo thành muối ammonium NH3 + HCl → NH4Cl (không màu) (ko màu) (khói trắng) => có hiện tượng xuất hiện khói trắng bốc lên. => có thể nhận biết ammonia bằng dung dịch HCl đặc 2NH3 + H2SO4 → (NH4)2SO4 Tác dụng với O2: 4NH3 + 3O2 2N2 + 6H2O Khi oxi hóa ammonia bằng oxygen trong không khí có xúc tác Pt, ở nhiệt độ cao: 4NH3 + 5O2 4 NO + 6H2O Kết luận: Ammonia có các tính chất hoá học cơ bản: - Tính base yếu - Tính khử |
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 11 Chân trời sáng tạo mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các bài soạn Giáo án Hóa học lớp 11 Chân trời sáng tạo hay, chuẩn khác:
Giáo án Hóa học 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Giáo án Hóa học 11 Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 11 (các môn học)
- Giáo án điện tử lớp 11 (các môn học)
- Giáo án Toán 11
- Giáo án Ngữ văn 11
- Giáo án Tiếng Anh 11
- Giáo án Vật Lí 11
- Giáo án Hóa học 11
- Giáo án Sinh học 11
- Giáo án Lịch Sử 11
- Giáo án Địa Lí 11
- Giáo án KTPL 11
- Giáo án HĐTN 11
- Giáo án Tin học 11
- Giáo án Công nghệ 11
- Giáo án GDQP 11
- Đề thi lớp 11 (các môn học)
- Đề thi Ngữ Văn 11 (có đáp án)
- Chuyên đề Tiếng Việt lớp 11
- Đề cương ôn tập Văn 11
- Đề thi Toán 11 (có đáp án)
- Đề thi Toán 11 cấu trúc mới
- Đề cương ôn tập Toán 11
- Đề thi Tiếng Anh 11 (có đáp án)
- Đề thi Tiếng Anh 11 mới (có đáp án)
- Đề thi Vật Lí 11 (có đáp án)
- Đề thi Hóa học 11 (có đáp án)
- Đề thi Sinh học 11 (có đáp án)
- Đề thi Lịch Sử 11
- Đề thi Địa Lí 11 (có đáp án)
- Đề thi KTPL 11
- Đề thi Tin học 11 (có đáp án)
- Đề thi Công nghệ 11
- Đề thi GDQP 11 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

