Cách giải bài tập về Chuỗi phản ứng hóa học của kim loại (hay, chi tiết)
Bài viết Cách giải bài tập về Chuỗi phản ứng hóa học của kim loại với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách giải bài tập về Chuỗi phản ứng hóa học của kim loại.
Cách giải bài tập về Chuỗi phản ứng hóa học của kim loại (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Tổng hợp bài tập về kim loại - Cô Nguyễn Thị Thu (Giáo viên VietJack)
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Nắm chắc các tính chất hóa học chung và các tính chất đặc trưng của từng nhóm kim loại để vận dụng viết phương trình phản ứng.
Ví dụ minh họa
Bài 1: Hoàn thành sơ đồ phản ứng sau:
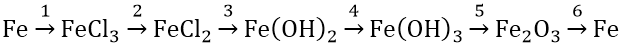
Lời giải:
(1) 2Fe + Cl2 → 2FeCl3
(2) 2FeCl3 + Fe → 3FeCl2
(3) FeCl2 + 2NaOH → Fe(OH)2 + NaCl
(4) 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
(5) 2Fe(OH)3 −tº→ Fe2O3 + 3H2O
(6) Fe2O3 + 2Al −tº→ 2Fe + Al2O3
Bài 2: Hoàn thành phương trình phản ứng theo sơ đồ sau:
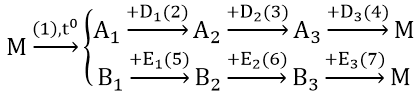
Cho biết: A1 là oxit kim loại A có điện tích hạt nhân là : 3,2.10-18 Culong; B1 là oxit phi kim B có cấu hình electron ở lớp vỏ ngoài cùng là 2s22p2
Lời giải:
Số điện tích hạt nhân của A = (3,2.10-18)/(1,6.10-19) = 20(Ca)
Vậy A1 là CaO.
B ở chu kì 2, nhóm IV A ⇒ (B là cacbon). Vậy B1 là CO2
Các phản ứng:
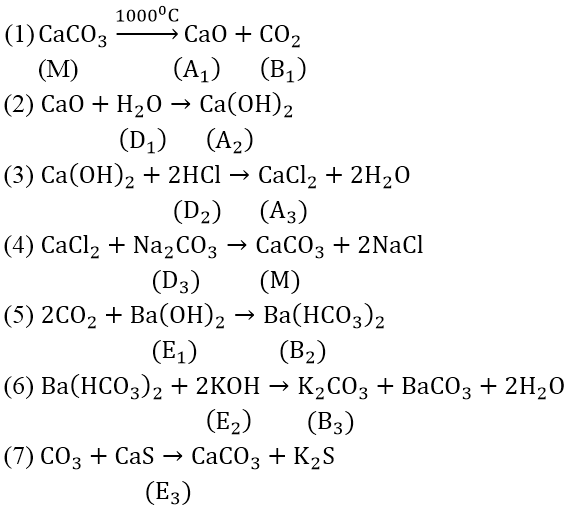
Bài 3: Hoàn thành sơ đồ phản ứng sau:
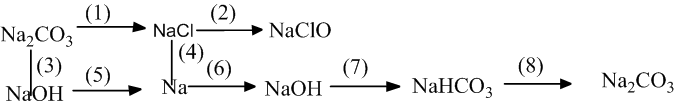
Lời giải:
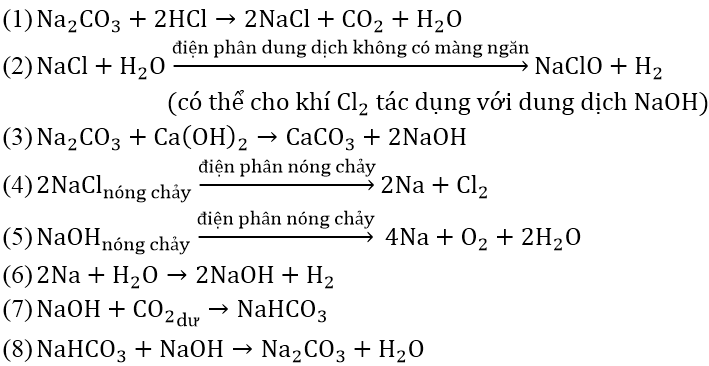
B. Bài tập trắc nghiệm
Bài 1: Cho các chất sau: Fe, FeCl2, FeCl3, FeSO4, Fe2(SO4)3, FeO, Fe2O3. Những chất có cả tính oxi hóa và tính khử là:
A. Fe, FeO, Fe2O3. B. FeO, FeCl2, FeSO4.
C. Fe, FeCl2, FeCl3. D. Fe, FeSO4, Fe2(SO4)3.
Lời giải:
Đáp án: B
Bài 2: Cho sơ đồ sau:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe → FeCl3.
Số phương trình phản ứng oxi hóa - khử trong dãy là:
A. 3 B. 4 C. 5 D. 6
Lời giải:
Đáp án: B
Những phản ứng có sự thay đổi số oxi hóa là phản ứng oxi hóa – khử
Fe + 2HCl → FeCl2 + H2
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
2Fe(OH)3 −tº→ Fe2O3 + 3H2O
Fe2O3 + 2Al −tº→ 2Fe + Al2O3
Fe + Cl2 → FeCl3
Bài 3: Phương trình phản ứng nào sau đây viết sai?
A. FeCO3 + 2HNO3 → Fe(NO3)2 + CO2 + H2O
B. 2FeCl2 + Cl2 → 2FeCl3
C. 2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
D. Fe2O3 + 6HNO3 đặc −tº→ 2Fe(NO3)3 + 3H2O.
Lời giải:
Đáp án: A
3FeCO3 + 10HNO3 → 3Fe(NO3)3 + 5H2O + NO + 3CO2
Bài 4: Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng dư chất nào sau đây?
A. Mg B. Cu C. Ba D. Na
Lời giải:
Đáp án: B
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Bài 5: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số phản ứng oxi hóa - khử là:
A. 5 B. 6 C. 7 D. 8
Lời giải:
Đáp án: C
Bài 6: Khi nung nóng hỗn hợp các chất Fe(NO3)2, Fe(OH)2 và FeCO3 trong không khí đến khối lượng không đổi thu được một chất rắn là:
A. FeO B. Fe C. Fe3O4 D. Fe2O3
Lời giải:
Đáp án: D
Bài 7: Cho sơ đồ sau: FeS2 → X → Y → Z → Fe
Các chất X, Y, Z lần lượt là:
A. FeS, Fe2O3, FeO. B. Fe3O4, Fe2O3, FeO.
C. Fe2O3, Fe3O4, FeO. D. FeO, Fe3O4, Fe2O3.
Lời giải:
Đáp án:C
2FeS2 + 11/2O2 −tº→ Fe2O3 + 4SO2
3Fe2O3 + CO −tº→ 2Fe3O4 + CO2
Fe3O4 + CO −tº→ 3FeO + CO2
FeO + CO −tº→ Fe + CO2
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 1: Tính chất chung của kim loại
- Dạng 3: Các dạng bài tập về dãy điện hóa kim loại và pin điện hóa
- Dạng 4: Phương pháp giải các bài toán về kim loại
- Dạng 5: Kim loại tác dụng với dung dịch axit
- Dạng 6: Kim loại tác dụng với dung dịch muối
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải (cơ bản – phần 1)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

