Các dạng bài tập Đại cương về kim loại (chọn lọc, có đáp án)
Các dạng bài tập Đại cương về kim loại (chọn lọc, có đáp án)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Phần Đại cương về kim loại Hóa học lớp 12 sẽ tổng hợp Lý thuyết, các dạng bài tập chọn lọc giúp ôn thi Tốt nghiệp môn Hóa và trên 250 bài tập trắc nghiệm chọn lọc có đáp án chi tiết. Vào Xem chi tiết để theo dõi các dạng bài Đại cương về kim loại tương ứng.
Tổng hợp Lý thuyết chương Đại cương về kim loại
- Lý thuyết Tính chất của Kim loại
- Lý thuyết Tính chất của Hợp kim
- Lý thuyết Dãy điện hóa của kim loại
- Lý thuyết Sự điện phân - Sự ăn mòn
- Lý thuyết về Kim loại và hợp kim
- Lý thuyết về Tính chất của kim loại
- Lý thuyết về Điều chế kim loại
Phương pháp giải Các dạng bài tập chương Đại cương về kim loại
- (5 dạng) bài tập về kim loại ôn thi Tốt nghiệp (có lời giải)
- Dạng 1: Tính chất chung của kim loại
- Dạng 2: Chuỗi phản ứng hóa học của kim loại
- Dạng 3: Các dạng bài tập về dãy điện hóa kim loại và pin điện hóa
- Dạng 4: Phương pháp giải các bài toán về kim loại
- Dạng 5: Kim loại tác dụng với dung dịch axit
- Dạng 6: Kim loại tác dụng với dung dịch muối
- Bài tập điện phân cơ bản có lời giải
- Bài tập điện phân nâng cao có lời giải
- Bài tập kim loại tác dụng với dung dịch muối cơ bản có lời giải
- Bài tập kim loại tác dụng với dung dịch muối nâng cao có lời giải
- Bài tập kim loại tác dụng với H2SO4 đặc, nóng có lời giải
- Bài tập kim loại tác dụng với HNO3 có lời giải
- Tổng hợp bài tập lý thuyết về ăn mòn điện hóa có lời giải
- Bài toán khử oxit kim loại bằng H2, CO hoặc C có lời giải
- Bài tập kim loại tác dụng với HCl, H2SO4 loãng có lời giải
- Câu hỏi lý thuyết đại cương kim loại ôn thi Tốt nghiệp có lời giải
- Trắc nghiệm lý thuyết Chương 5 Đại cương kim loại có lời giải
- Bài tập về dãy điện hóa của kim loại và cách giải
- Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải
- Các dạng bài toán điện phân và cách giải
- Bài tập về sự ăn mòn kim loại và cách giải
Bài tập trắc nghiệm
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải (cơ bản – phần 1)
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải (cơ bản – phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải (nâng cao – phần 1)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải (nâng cao – phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải (nâng cao – phần 3)
Bài tập kim loại tác dụng với dung dịch muối cơ bản
I. Kiến thức chung
1)Kim loại tác dụng với dung dịch muối
- Để kim loại M đẩy được kim loại X ra khỏi dung dịch muối của nó với phản ứng: xM (r) + nX+ (dd) → xMn+ (dd) + nX (r)
- M đứng trước X trong dãy thế điện cực chuẩn
- Cả M và X đều không tác dụng được với nước ở điều kiện thường
- Muối tham gia phản ứng và muối tạo thành phải là muối tan
- Khối lượng chất rắn tăng: ∆m↑ = mX tạo ra – mM tan
- Khối lượng chất rắn giảm: ∆m↓ = mM tan – mX tạo ra
- Khối lượng chất rắn tăng = khối lượng dung dịch giảm
- Ngoại lệ:
- Nếu M là kim loại kiềm, kiềm thổ (Ca, Sr, Ba) thì M sẽ khử H+ của H2O thành H2 và tạo thành dung dịch bazơ kiềm. Sau đó là phản ứng trao đổi giữa muối và bazơ kiềm
- Ở trạng thái nóng chảy vẫn có phản ứng: 3Na + AlCl3 (khan) → 3NaCl + Al
+ Với nhiều anion có tính oxi hóa mạnh như NO3–; MnO4– , …thì kim loại M sẽ khử các anion trong môi trường axit (hoặc bazơ)
- Hỗn hợp các kim loại phản ứng với hỗn hợp dung dịch muối theo thứ tự ưu tiên: kim loại khử mạnh nhất tác dụng với cation oxi hóa mạnh nhất để tạo ra kim loại khử yếu nhất và cation oxi hóa yếu nhất
- Thứ tự tăng dần giá trị thế khử chuẩn (Eo) của một số cặp oxi hóa – khử:
Mg2+/Mg < Al3+/Al < Zn2+/Zn < Cr3+/Cr < Fe2+/Fe < Ni2+/Ni < Sn2+/Sn < Pb2+/Pb < 2H+/H2 < Cu2+/Cu < Fe3+/Fe2+ < Ag+/Ag < Hg2+/Hg < Au3+/Au
2) Một số chú ý khi giải bài tập:
- Phản ứng của kim loại với dung dịch muối là phản ứng oxi hóa – khử nên thường sử dụng phương pháp bảo toàn mol electron để giải các bài tập phức tạp, khó biện luận như hỗn hợp nhiều kim loại tác dụng với dung dịch chứa hỗn hợp nhiều muối. Các bài tập đơn giản hơn như một kim loại tác dụng với dung dịch một muối, hai kim loại tác dụng với dung dịch một muối,…có thể tính toán theo thứ tự các phương trình phản ứng xảy ra
- Sử dụng phương pháp tăng giảm khối lượng để tính khối lượng thanh kim loại sau phản ứng,…
- Từ số mol ban đầu của các chất tham gia phản ứng → biện luận các trường hợp xảy ra
- Nếu chưa biết số mol các chất phản ứng thì dựa vào thành phần dung dịch sau phản ứng và chất rắn thu được → biện luận các trường hợp xảy ra
- Kim loại khử anion của muối trong môi trường axit (bazơ) thì nên viết phương
trình dạng ion thu gọn
- Kim loại (Mg → Cu) đẩy được Fe 3+ về Fe 2+. Ví dụ:
Fe + 2Fe 3+ → 3Fe 2+
Cu + 2Fe 3+ → Cu 2+ + 2Fe 2+
Fe + 2Ag+ → Fe 2+ + 2Ag.
Nếu Fe hết, Ag+ còn dư thì:
Fe 2+ + Ag + → Fe 3+ + Ag
II. VÍ DỤ MINH HỌA
Bài 1: Nhúng thanh kim loại kẽm vào một dung dịch chứa hỗn hợp 3,2 gam CuSO4 và 6,4 gam CdSO4. Hỏi sau khi Cu và Cd bị đẩy hoàn toàn khỏi dung dịch thì khối lượng thanh kẽm tăng hay giảm bao nhiêu?
Hướng dẫn:
Ta có: nCuSO4 = 3,2/160 = 0,02 (mol); nCdSO4 = 6,24/208 = 0,03(mol)
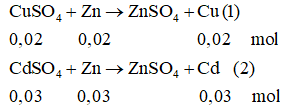
Từ (1) và (2) ⇒ ∑mCu + Cd = (0,02.64) + (0,03.112) = 4,64(gam)
Và mZn tham gia phản ứng = (0,02 + 0,03).65 = 3,25(gam)
Vậy khối lượng thanh Zn tăng: 4,64 - 3,25 = 1,39(gam)
Bài 2: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
Hướng dẫn:
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy, nCuSO4 phản ứng = 0,8/8 = 0,1(mol)và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 3: Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M, khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B.
a) Tính số gam chất rắn A.
b) Tính nồng độ mol của các chất trong dung dịch B.
Hướng dẫn:
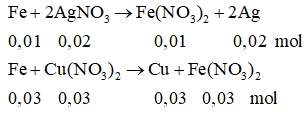
nAgNO3 = 0,02 (mol); nFe = 0,04 (mol); nCu(NO3)2 = 0,1(mol)
nFe phản ứng (1) = 0,01(mol); nFe pư (2) = 0,04 - 0,01 = 0,03 (mol)
nCu(NO3)2dư = 0,1 - 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08(gam)
Dung dịch B: Fe(NO3)2: 0,04 (mol) ⇒ CM = 0,2 M
Cu(NO3)2: 0,07 (mol) ⇒ CM = 0,35M
III. BÀI TẬP VẬN DỤNG
Bài 1: Cho m gam hỗn hợp bột các kim loại Ni và Cu vào dung dịch AgNO3 dư. Khuấy kĩ cho đến khi phản ứng kết thúc thu được 54 gam kim loại. Mặt khác cũng cho m gam hỗn hợp bột các kim loại trên vào dung dịch CuSO4 dư, khuấy kĩ cho đến khi phản ứng kết thúc, thu được kim loại có khối lượng bằng
(m + 0,5) gam. Giá trị của m là:
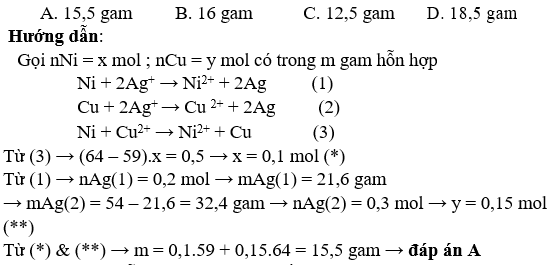
Bài 2: Hòa tan hỗn hợp bột kim loại gồm 8,4 gam Fe và 6,4 gam Cu vào 350 ml dung dịch AgNO3 2M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là:
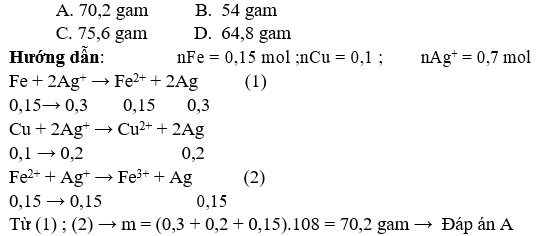
Bài 3: Cho 2,24 gam bột sắt vào 200 ml dung dịch chứa hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là:
A. 2,80 gam B. 4,08 gam
C. 2,16 gam D. 0,64 gam
Hướng dẫn:
nFe = 0,04 mol ;nAg+ = 0,02 mol ; nCu2+ = 0,1 mol
Thứ tự các phản ứng xảy ra là:
(Fe2+/Fe < Cu2+/Cu < Fe3+ < Fe2+ < Ag+ < Ag)
Fe + 2Ag+ → Fe2+ + 2Ag (1)
0,01← 0,02 → 0,02
Fe + Cu2+ → Fe2+ + Cu (2)
0,03→ 0,03
Từ (1) & (2) → mY = 0,02.108 + 0,03.64 = 4,08 gam → đáp án B
Bài 4: Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
A. 10,5g
B. 10,76g
C. 11,2g
D. 12,8g
Đáp án: B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
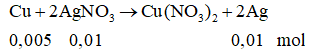
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
Bài 5: Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M
B. 0,5M
C. 0,65M
D. 0,8M
Đáp án: C
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:
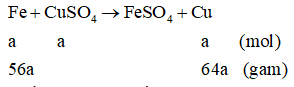
Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4] = 0,75M
Bài 6: Ngâm một lá Zn trong dung dịch có hòa tan 8,32 gam CdSO4. Phản ứng xong thấy khối lượng là Zn tăng 2,35%. Vậy khối lượng của là Zn trước khi tham gia phản ứng là:
A. 60g
B. 70g
C. 80g
D. 85g
Đáp án: C
Số mol CdSO4 = 8,32/208 = 0,04 (mol)
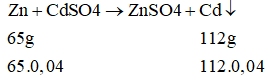
Khối lượng lá Zn tăng: 112.0,4 - 65.0,04 = 1,88 (g)
⇒ Khối lượng lá Zn trước khi phản ứng: 1,88.100/2,35 = 80 (g)
Bài 7: Ngâm một lá kẽm trong dung dịch chứa 2,24 gam ion kim loại M2+ trong muối sunfat sau phản ứng, khối lượng lá Zn tăng lên 0,94 gam. Vậy M là:
A. Pb
B. Cu
C. Fe
D. Cd
Đáp án: D
Phương trình phản ứng:
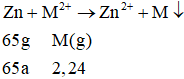
Khối lượng lá Zn tăng: 2,24 - 65a = 0,94 → a = 0,02 mol
M = 2,24/0,02 = 112 → M là Cd
Bài tập kim loại tác dụng với H2SO4 đặc, nóng
A. Phương pháp giải
- Với bài toán này cần nhớ các bán phản ứng quan trọng sau:
-
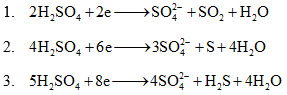
- Chú ý vận dụng các định luật bảo toàn (đặc biệt là BTE)
- BT Electron : n electron cho = n electron nhận
- n electron nhận = 2n SO2 + 6n S + 8n H2S ( n electron nhận = 2 n SO42- )
B. Ví dụ minh họa
Câu 1: Hòa tan a mol Fe trong dung dịch H2SO4 thu được dung dịch X và 12,32 lít SO2 (đktc) là sản phẩm khử duy nhất. Cô cạn dung dịch X thu được 75,2 gam muối khan. Giá trị của a là:
A. 0,4 B. 0,6
C. 0,3 D. 0,5
Định hướng tư duy giải:
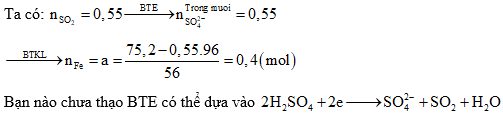
Giải thích tư duy:
Bài toàn này đề không nói axit dư nên không thể cho Fe nhảy hết lên được. Ta phải dùng đổi e lấy điện tích âm
được. Ta phải dùng đổi e lấy điện tích âm  rồi lấy khối lượng muối – khối lượng
rồi lấy khối lượng muối – khối lượng 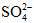
Câu 2: Hòa tan hết hỗn hợp X chứa Cu và Fe trong dung dịch H2SO4 đặc, nóng. Sau phản ứng thu được khí và dung dịch Y chứa m gam muối (trong đó S chiếm 22,472% về khối lượng). Mặt khác, đổ dung dịch NaOH dư vào Y thấy có 40,2 gam kết tủa xuất hiện. Giá trị của m là :
A. 74,2 B. 68,8
C. 71,2 D. 66,8
Định hướng tư duy giải:
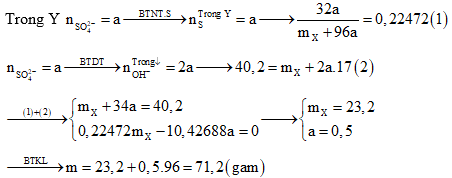
Giải thích tư duy:
Bài toán này đề không nói axit dư nên không thể cho Fe nhảy hết lên  được. Chuyển dịch điện tích
được. Chuyển dịch điện tích 
Câu 3: Cho Fe tác dụng hết với dung dịch H2SO4 đặc nóng thu được khí SO2 (sản phẩm khử duy nhất) và dung dịch X chứa 8,28 gam muối. Cho Ba(OH)2 dư vào X thì thu được 18,54 gam kết tủa. Số mol H2SO4 đã phản ứng là?
A. 0,15 B. 0,12
C. 0,20 D. 0,30
Định hướng tư duy giải:
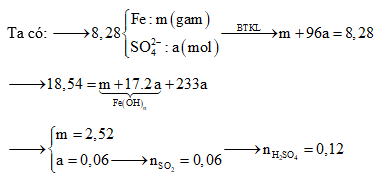
Giải thích tư duy:
Bài toán này đề không nói axit dư nên không thể cho Fe nhảy hết lên được. Muối gồm sắt và còn kết tủa là các hidroxit của sắt
được. Muối gồm sắt và còn kết tủa là các hidroxit của sắt  và BaSO4. Dùng chuyển dịch điện tích từ
và BaSO4. Dùng chuyển dịch điện tích từ  thành
thành 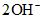
C. Bài tập vận dụng
Câu 1: Cho hỗn hợp A gồm x mol Fe và 0,2x mol Cu tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 1 : 3), thu được một sản phẩm khử duy nhất SO2 và dung dịch B. Số mol khí SO2 thoát ra là
A. x B. l,7x
C. 0,5y D. y
Định hướng tư duy giải
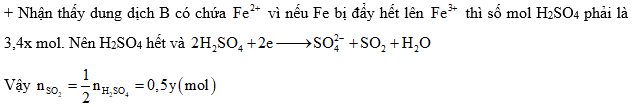
Câu 2: Cho 12 gam hỗn hợp hai kim loại Cu, Fe tan hoàn toàn trong H2SO4 đặc, nóng, dư thu được 5,6 lít SO2 sản phẩm khử duy nhất ở. Tính % theo khối lượng của Cu trong hỗn hợp là
A. 53,33% B. 33,33%
C. 43,33% D. 50,00%
Định hướng tư duy giải

Câu 3: Cho 4,5 gam một kim loại R tan hoàn toàn trong H2SO4 đặc nóng dư thu được 2,24 lít hỗn hợp hai khí SO2 và H2S (đktc) có tỉ khối so với H2 là 24,5 và dung dịch X. Tìm kim loại R và khối lượng muối tạo thành trong dung dịch sau phản ứng
A. Al, 28,5 gam B. Al, 34,2 gam
C. Fe, 28,5 gam D. Cu, 32,0 gam
Định hướng tư duy giải
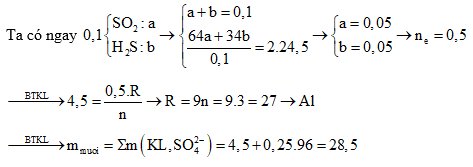
Câu 4: Hòa tan 30 gam hỗn hợp một số kim loại vào dung dịch H2SO4 đặc nóng dư thu được dung dịch X và 0,15 mol SO2, 0,1 mol S và 0,005 mol H2S. Khối lượng muối tạo thành sau phản ứng là :
A. 78 g B. 120,24g
C. 44,4g D. 75,12g
Định hướng tư duy giải
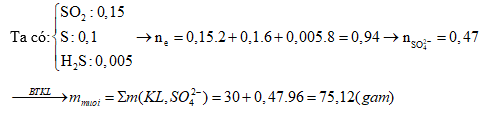
Câu 5: Hòa tan 23,4 gam hỗn hợp gồm Al, Fe, Cu bằng một lượng vừa đủ dung dịch H2SO4, thu được 15,12 lít khí SO2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là:
A. 153,0 B. 95,8
C. 88,2 D. 75,8
Định hướng tư duy giải
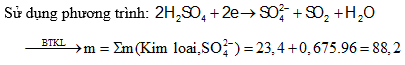
Câu 6: Cho Fe tác dụng hết vói dung dịch H2SO4 đặc nóng thu được khí SO2 (sản phẩm khử duy nhất) và 8,28 gam muối. Biết số mol Fe bằng 37,5% số mol H2SO4 phản ứng. Khối lượng Fe đã tham gia phản ứng là
A. 1,68 gam B. 1,12 gam
C. 1,08 gam D. 2,52 gam
Định hướng tư duy giải
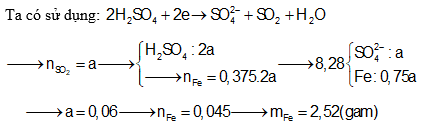
Câu 7: Hòa tan 0,1 mol Al và 0,2 mol Cu trong dung dịch H2SO4 đặc dư thu được V lít SO2 (ở 0°C, 1 atm). Giá trị của V là:
A. 3,36 B. 4,48
C. 7,84 D. 5,6
Định hướng tư duy giải
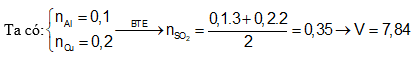
Câu 8: Cho 5,94g Al tác dụng vừa đủ với dung dịch H2SO4 đặc nóng thu được 1,848 lít sản phẩm (X) có lưu huỳnh (đktc), muối sunfat và nước. Cho biết (X) là khí gì trong hai khí SO2, H2S?
A. H2S B. SO2
C. Cả hai khí D. S
Định hướng tư duy giải
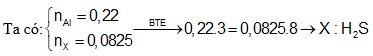
Câu 9: Hỗn hợp X gồm Fe và C có tỉ lệ mol tương ứng là 1 : 2. Cho 8 gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc, nóng dư thì thu được V lít khí ở đktc. Giá trị của V là
A. 16,8 lít. B. 17,92 lít
C. 6,72 lít. D. 20,16 lít
Định hướng tư duy giải
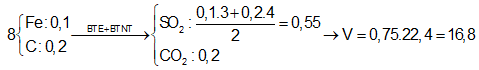
Câu 10: Hòa tan hoàn toàn 16,3 gam hỗn hợp X gồm Mg, Al và Fe trong dung dịch H2SO4 đặc nóng thu được 0,55 mol SO2. Mặt khác, đốt cháy hoàn toàn lượng kim loại trên thu được m gam oxit. Giá trị của m là:
A. 22,9 gam B. 25,1 gam
C. 55,2 gam D. 51,8 gam
Định hướng tư duy giải
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Chuyên đề ester - lipid
- Chuyên đề Cacbohiđrat
- Chuyên đề Amin, amino acid và protein
- Chuyên đề polymer và vật liệu polymer
- Chuyên đề Kim loại kiềm, kim loại kiềm thổ, nhôm
- Chuyên đề Sắt và một số kim loại quan trọng
- Chuyên đề Phân biệt một số chất vô cơ
- Chuyên đề Hóa học và vấn đề môi trường
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

