Cách giải bài tập Kim loại tác dụng với dung dịch muối (hay, chi tiết)
Bài viết Cách giải bài tập Kim loại tác dụng với dung dịch muối với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách giải bài tập Kim loại tác dụng với dung dịch muối.
Cách giải bài tập Kim loại tác dụng với dung dịch muối (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Tổng hợp bài tập về kim loại - Cô Nguyễn Thị Thu (Giáo viên VietJack)
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Vận dụng dãy thế điện cực chuẩn:
- Kim loại của cặp oxi hóa – khử có thế điện cực chuẩn nhỏ hơn khử được cation kim loại của cặp oxi hóa – khử có thế điện cực chuẩn lớn hơn ra khỏi dung dịch muối (hay nói các khác: kim loại có tính khử mạnh và không tan trong nước đẩy được kim loại có tính khử yếu hơn ra khỏi muối).
- Trường hợp hỗn hợp nhiều kim loại tác dụng với hỗn hợp nhiều muối, thì phản ứng xảy ra ưu tiên theo thứ tự: chất oxi hóa mạnh tác dụng với chất khử mạnh để tạo ra chất oxi hóa yếu hơn và chất khử yếu hơn.
Một số lưu ý
- Đối với bài tập một kim loại tác dụng với dung dịch gồm nhiều muối thì kim loại sẽ tác dụng với muối có chứa ion kim loại có tính oxi hóa mạnh hơn trước. nếu sau phản ứng này, kim loại còn dư mới tiếp tục xảy ra phản ứng với muối còn lại.
Chẳng hạn: cho Fe vào dung dịch gồm AgNO3 và Cu(NO3 )2, thì Fe sẽ tác dụng với dung dịch AgNO3 trước, sau đó nếu Fe dư thì mới xảy ra tiếp phản ứng Fe tác dụng với dung dịch muối Cu(NO3)2.
- Đối với bài tập hỗn hợp kim loại tác dụng với dung dịch gồm nhiều muối nếu làm thông thường sẽ phải xét nhiều trường hợp.
Chẳng hạn: Cho Fe, Al tác dụng với dung dịch gồm AgNO3 và Cu(NO3)2. Đầu tiên kim loại mạnh hơn sẽ tác dụng với muối có chứa ion kim loại có tính oxi hóa mạnh hơn.
Al + 3Ag+ → Al3+ + 3Ag (1)
Sau phản ứng (1) nếu Ag dư:
2Al + 3Cu2+ → 2Al3+ + 3Cu (2)
Sau phản ứng (2) nếu Cu2+ dư:
Fe + Cu2+ → Cu + Fe2+ (3)
Cách làm nhanh: dùng bảo toàn electron sẽ tránh được việc phải xét nhiều trường hợp.
Ví dụ minh họa
Bài 1: Nhúng thanh kim loại kẽm vào một dung dịch chứa hỗn hợp 3,2 gam CuSO4 và 6,4 gam CdSO4. Hỏi sau khi Cu và Cd bị đẩy hoàn toàn khỏi dung dịch thì khối lượng thanh kẽm tăng hay giảm bao nhiêu?
Lời giải:
Ta có: nCuSO4 = 3,2/160 = 0,02 (mol); nCdSO4 = 6,24/208 = 0,03(mol)
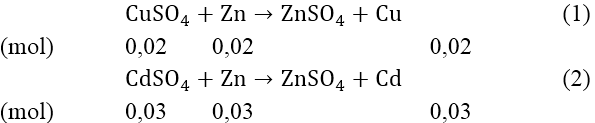
Từ (1) và (2) ⇒ ∑mCu + Cd = (0,02.64) + (0,03.112) = 4,64(gam)
Và mZn tham gia phản ứng = (0,02 + 0,03).65 = 3,25(gam)
Vậy khối lượng thanh Zn tăng: 4,64 - 3,25 = 1,39(gam)
Bài 2: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
Lời giải:
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy, nCuSO4 phản ứng = 0,8/8 = 0,1(mol)và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 3: Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M, khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B.
a) Tính số gam chất rắn A.
b) Tính nồng độ mol của các chất trong dung dịch B.
Lời giải:
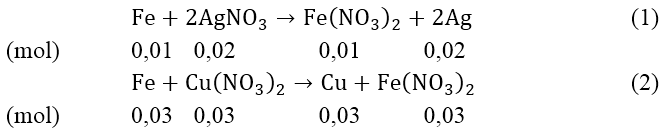
nAgNO3 = 0,02 (mol); nFe = 0,04 (mol); nCu(NO3)2 = 0,1(mol)
nFe phản ứng (1) = 0,01(mol); nFe pư (2) = 0,04 - 0,01 = 0,03 (mol)
nCu(NO3)2dư = 0,1 - 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08(gam)
Dung dịch B: Fe(NO3)2: 0,04 (mol) ⇒ CM = 0,2 M
Cu(NO3)2: 0,07 (mol) ⇒ CM = 0,35M
Bài 4: Cho 0,774 gam hỗn hợp Zn và Cu vào 500 ml dung dịch AgNO3 nồng độ 0,04M. Sau khi các phản ứng xảy ra hoàn toàn được chất rắn X nặng 2,288 gam chất rắn. Hãy xác định thành phần của ?
Lời giải:
Ta có: nAgNO3 = 0,5.0,04 = 0,02(mol)
Thứ tự phản ứng:
Zn + 2AgNO3 → Zn(NO3 )2 + 2Ag (1)
Cu + 2AgNO3 → Cu(NO3 )2 + 2Ag (2)
Nếu Zn, Cu phản ứng hết thì khối lượng kim loại thu được tối đa nặng:
108 . 0,02 = 2,16 (gam) < mX ⇒ kim loại còn dư ⇒ AgNO3 phản ứng hết.
Nếu Cu chưa phản ứng thì phản ứng (1) làm tăng một lượng:
108.0,02 - 65.0,02/2 = 1,51 (gam) tức khối lượng chất rắn lúc đó nặng:
0,774 + 1,51 = 2,284 (gam) < mX ⇒ Cu có phản ứng nhưng còn dư.
Vậy X gồm Ag và Cu.
B. Bài tập trắc nghiệm
Bài 1: Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Vậy khối lượng của vật sau phản ứng là:
A. 10,5g
B. 10,76g
C. 11,2g
D. 12,8g
Lời giải:
Đáp án: B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
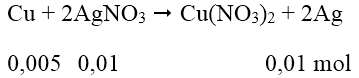
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)
Bài 2: Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M
B. 0,5M
C. 0,65M
D. 0,8M
Lời giải:
Đáp án: C
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:

Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4] = 0,75M
Bài 3: Ngâm một lá Zn trong dung dịch có hòa tan 8,32 gam CdSO4. Phản ứng xong thấy khối lượng là Zn tăng 2,35%. Vậy khối lượng của là Zn trước khi tham gia phản ứng là:
A. 60g
B. 70g
C. 80g
D. 85g
Lời giải:
Đáp án: C
Số mol CdSO4 = 8,32/208 = 0,04 (mol)
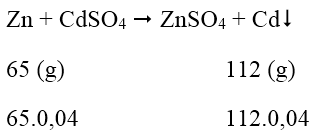
Khối lượng lá Zn tăng: 112.0,4 - 65.0,04 = 1,88 (g)
⇒ Khối lượng lá Zn trước khi phản ứng: 1,88.100/2,35 = 80 (g)
Bài 4: Ngâm một lá kẽm trong dung dịch chứa 2,24 gam ion kim loại M2+ trong muối sunfat sau phản ứng, khối lượng lá Zn tăng lên 0,94 gam. Vậy M là:
A. Pb
B. Cu
C. Fe
D. Cd
Lời giải:
Đáp án: D
Phương trình phản ứng:
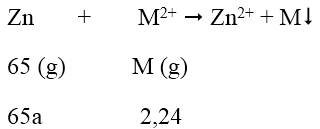
Khối lượng lá Zn tăng: 2,24 - 65a = 0,94 → a = 0,02 mol
M = 2,24/0,02 = 112 → M là Cd
Bài 5: Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hia giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là:
A. Cd
B. Fe
C. Zn
D. Cu
Lời giải:
Đáp án: C
Phương trình phản ứng:
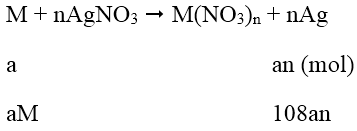
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)
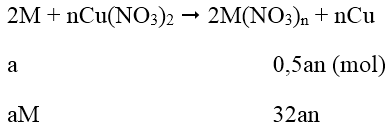
Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chon M = 32,5n
Khi n = 2 thì M = 65
Vậy M = Zn
Bài 6: Cho 0,01 mol Fe vào 50ml dung dịch AgNO3 1M khi phản ứng kết thúc khối lượng Ag thu được là:
A. 3,6
B. 3,24
C. 2,16
D. 1,08
Lời giải:
Đáp án: B
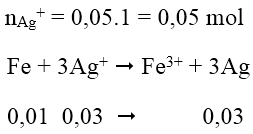
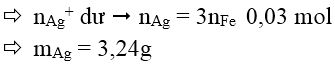
Bài 7: Hòa tan 3 gam một hợp kim Cu-Ag trong dung dịch HNO3 tạo ra được 7,34 gam hỗn hợp gồm 2 muối Cu(NO3)2 và AgNO3. Vậy thành phần % của Cu và Ag trong hợp kim là:
A. 60% và 40%
B. 64% và 36%
C. 70% và 30%
D. 55% và 45%
Lời giải:
Đáp án: B
Sơ đồ chuyển hóa sau:
Cu → Cu(NO3)2
Ag → AgNO3
Ta lập được hệ gồm 2 phương trình:
Giải ra được: x = 0,03, y = 0,01 → %Cu = 64%
Bài 8: Ngâm một lá kẽm vào dung dịch chứa 2,24 gam ion kim loại M2+. Phản ứng xong, khối lượng lá Zn tăng thêm 0,94 gam. M2+ là ion kim loại nào sau đây?
A. Sn2+
B. Cu2+
C. Pb2+
D. Cd2+
Lời giải:
Đáp án:D
Chọn D
Phản ứng:
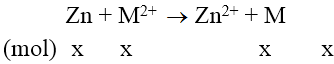
Vì khối lượng thanh kẽm tăng nên áp dụng phương trình đại số sau:
M.x – 65x = 0,94 (1)
Và
Từ (1) và (2)
⇒ 2,24M – 145,6 = 0,94M ⇔ 1,3M = 145,6 ⇒ M = 112 : cađimin (Cd)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 1: Tính chất chung của kim loại
- Dạng 2: Chuỗi phản ứng hóa học của kim loại
- Dạng 3: Các dạng bài tập về dãy điện hóa kim loại và pin điện hóa
- Dạng 4: Phương pháp giải các bài toán về kim loại
- Dạng 5: Kim loại tác dụng với dung dịch axit
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải (cơ bản – phần 1)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều

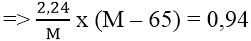



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

