Chuyên đề Hợp chất chứa Nitrogen lớp 12
Tài liệu chuyên đề Hợp chất chứa Nitrogen lớp 12 trong Chuyên đề dạy thêm Hóa học 12 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa 12.
Chuyên đề Hợp chất chứa Nitrogen lớp 12
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Chỉ từ 300k mua trọn bộ Chuyên đề dạy thêm Hóa học 12 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chủ đề 1: Amine
* Hệ thống lý thuyết
I. Khái niệm, phân loại, đồng phân, danh pháp
1. Khái niệm
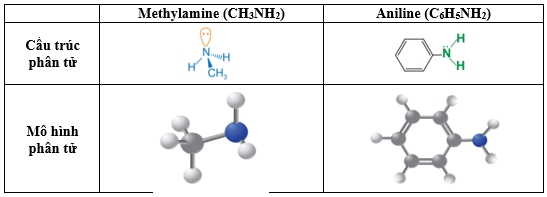
- Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
VD: CH3NH2, C6H5NH2, CH3 – NH – CH3, (CH3)3N, …
2. Phân loại
|
Theo bậc amine |
Theo bản chất gốc hydrocarbon |
|
- Bậc amine = số gốc hydrocarbon (R) liên kết trực tiếp với nguyên tử nitrogen. ♦ Amine bậc một: R – NH2 ♦ Amine bậc hai: R – NH – R’ ♦ Amine bậc ba: |
- Được phân thành nhiều loại trong đó có hai loại điển hình: ♦ Alkylamine: Nhóm amine liên kết với gốc alkyl. Công thức: CnH2n+3N (n ≥ 1). VD: C2H5NH2, CH3 – NH – CH3, … ♦ Arylamine (amine thơm): Nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene. VD: C6H5-NH2 (C6H5-: phenyl), … |
3. Đồng phân
- Amine từ 2C trở lên có thể có các đồng phân: bậc amine, mạch carbon, vị trí nhóm amine.
- Khi viết đồng phân amine thì viết theo từng bậc, số đồng phân alkylamine: 2n-1 (n < 5).
4. Danh pháp
♦ Tên gốc chức = tên gốc hydrocabon + amine (viết liền).
♦ Tên thay thế
+ Tên amine bậc một = tên hydrocarbon (bỏ e) + vị trí nhóm amine + amine
+ Tên amine bậc hai = N – tên gốc hydrocarbon + tên gốc hydrocarbon mạch chính + vị trí nhóm amine + amine
+ Tên amine bậc ba = N – tên gốc HC thứ nhất – N – tên gốc HC thứ hai + tên gốc hydrocarbon mạch chính + vị trí nhóm amine + amine (nếu gốc giống nhau thì dùng tiền tố di (2), tri (3), …)
♦ Tên thông thường: VD: C6H5NH2: aniline.
|
Amine |
Tên gốc – chức |
Tên thay thế |
|
CH3NH2 |
methylamine |
methanamine |
|
CH3CH2NH2 |
ethylamine |
Ethanamine |
|
CH3CH2CH2NH2 |
propylamine |
Propan – 1 – amine |
|
CH3 – CH(NH2) – CH3 |
isopropylamine |
Propan – 2 – amine |
|
CH3 – NH – CH3 |
dimethylamine |
N – methylmethanamine |
|
(CH3)3N |
trimethylamine |
N, N – dimethylmethanamine |
II. Đặc điểm cấu tạo
- Trong phân tử amine, nguyên tử nitrogen còn cặp electron chưa liên kết tương tự ammonia ⇒ Amine có một số tính chất hóa học tương tự ammonia, riêng aniline còn dễ tham gia phản ứng thế nguyên tử hydrogen trong nhân thơm do ảnh hưởng của nhóm -NH2.
III. Tính chất vật lí
- Ở điều kiện thường, CH3NH2, C2H5NH2, CH3 – NH – CH3, (CH3)3N là những chất khí có mùi tanh của cá hoặc mùi khai; các amin có phân tử khối lớn hơn là chất lỏng hoặc rắn.
- Các amine có số carbon nhỏ thường tan tốt trong nước do tạo được liên kết hydrogen với nước, độ tan giảm khi số nguyên tử carbon trong gốc hydrocarbon tăng.
- Amine có nhiệt độ sôi cao hơn so với hydrocarbon có cùng số nguyên tử carbon.
Thứ tự giảm nhiệt độ sôi: Hợp chất ion > carboxylic acid > alcohol > amine > ester > hydrocarbon
- Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước.
IV. Tính chất hóa học
1. Tính base và phản ứng tạo phức
(a) Tính base
- Tương tự ammonia, các amine thể hiện tính base yếu: RNH2 + H2O RNH3+ + OH-
- Tính base: aniline < NH3 < alkylamine.
- Thí nghiệm thể hiện tính base của amine:
|
|
Đĩa thủy tinh |
Ống nghiệm (1) |
Ống nghiệm (2) |
|
Bước 1 |
Đặt vào mẩu giấy quỳ tím. |
Lấy 2 mL dung dịch CH3NH2 và nhỏ thêm vài giọt phenolphthalein. |
Lấy khoảng 1 mL dung dịch FeCl3. |
|
Bước 2 |
Nhỏ vài giọt dung dịch CH3NH2 vào mẩu giấy quỳ tím. |
Nhỏ từ từ 2 mL dung dịch HCl vào, lắc đều. |
Nhỏ từ từ khoảng 3 mL dung dịch CH3NH2 vào, lắc đều. |
|
Hiện tượng |
Quỳ tím chuyển màu xanh. |
Dung dịch từ màu hồng chuyển thành mất màu. |
Xuất hiện kết tủa nâu đỏ. |
♦ Đổi màu chất chỉ thị: Alkylamine đổi màu quỳ tím → xanh, phenolphthalein → hồng, aniline không làm đổi màu quỳ tím và phenolphthalein vì là base yếu hơn.
♦ Tác dụng với acid → muối ammonium
TQ: RNH2 + HCl → RNH3Cl
CH3NH2 + HCl → CH3NH3Cl
C6H5NH2 + HCl → C6H5NH3Cl
♦ Tác dụng với dung dịch muối → Muối ammonium + base mới (kết tủa)
TQ: 3RNH2 + 3H2O + FeCl3 → 3RNH3Cl + Fe(OH)3↓nâu đỏ
3CH3NH2 + 3H2O + FeCl3 → CH3NH3Cl + Fe(OH)3↓nâu đỏ
(b) Khả năng tạo phức
♦ Thí nghiệm tạo phức của methylamine:
- Bước 1: Cho khoảng 2 mL dung dịch CuSO4 0,1 M vào ống nghiệm.
- Bước 2: Thêm từ từ dung dịch methylamine 0,1 M vào ống nghiệm, lắc đều.
- Hiện tượng: Xuất hiện kết tủa xanh lam sau đó kết tủa tan hết.
- Các amine như methylamine, ethylamine có khả năng hòa tan Cu(OH)2 tạo dung dịch phức chất có màu xanh lam. PTHH: 4CH3NH2 + Cu(OH)2 → [Cu(CH3NH2)4](OH)2
Chủ đề 2: Anino acid
* Kiến thức cần nhớ
I. Khái niệm và danh pháp
1. Khái niệm
- Amino acid là hợp chất hữu cơ tạp chức, trong phân tử chứa đồng thời nhóm amino (-NH2) và nhóm carboxyl (-COOH).
- CTTQ: (NH2)a – R – (COOH)b
- Các amino acid thiên nhiên hầu hết là α – amino acid (R – CH(NH2) – COOH).
- Có khoảng 20 loại amino acid cấu thành nên protein trong cơ thể (amino acid tiêu chuẩn) được chia thành: amino acid thiết yếu (cơ thể không tự tổng hợp được) và amino acid không thiết yếu (cơ thể tự tổng hợp được).
2. Danh pháp
- Tên thay thế = Vị trí NH2 (2, 3, …) + amino + tên thay thế của carboxylic tương ứng.
- Tên bán hệ thống = Vị trí NH2 (α, β, …) + amino + tên thông thường carboxylic acid tương ứng.
|
Công thức |
Tên thay thế |
Tên bán hệ thống |
Tên thường |
Kí hiệu |
|
H2NCH2COOH |
Aminoethanoic acid |
Aminoacetic acid |
Glycine |
Gly |
|
CH3CH(NH2)COOH |
2–aminopropanoic acid |
α-aminopropionic acid |
Alanine |
Ala |
|
(CH3)2CHCH(NH2)COOH |
2-amino-3-methylbutanoic acid |
α-aminoisovaleric acid |
Valine |
Val |
|
HOOC(CH2)2CH(NH2)COOH
|
2-aminopentane-1,5-dioic acid |
α-aminoglutaric acid |
Glutamic acid |
Glu |
|
H2N(CH2)4CH(NH2)COOH
|
2,6-diaminohexanoic acid |
-diamino caproic acid |
Lysine |
Lys |
II. Đặc điểm cấu tạo
- Các nhóm -COOH và nhóm -NH2 tương tác với nhau làm cho phân tử amino acid tồn tại chủ yếu ở dạng ion lưỡng cực. H2N – CH2 – COOH
dạng phân tử dạng ion lưỡng cực (chủ yếu)
- Trong một số trường hợp, để đơn giản amino acid thường được biểu diễn ở dạng phân tử.
III. Tính chất vật lí
- Ở điều kiện thường, amino acid là chất rắn, khi ở dạng kết tinh chúng không có màu.
- Amino acid có nhiệt độ nóng chảy cao và thường tan tốt trong nước vì chúng tồn tại ở dạng ion lưỡng cực.
IV. Tính chất hóa học
1. Tính chất lưỡng tính
- Tính base: H2N – CH2 – COOH + HCl → ClH3N – CH2 – COOH
- Tính acid: H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O
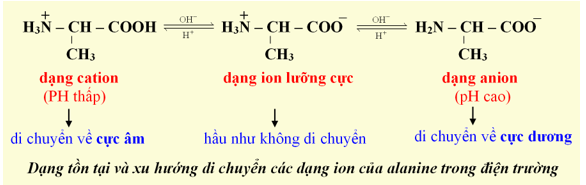
2. Tính chất điện di
- Trong dung dịch, dạng ion chủ yếu của amino acid phụ thuộc vào pH của dung dịch và bản chất của amino acid: Ở pH thấp amino acid tồn tại chủ yếu ở dạng cation (tích điện +), ngược lại ở pH cao amino acid tồn tại chủ yếu dạng anion (tích điện -).
- pH thay đổi làm amino acid tích điện khác nhau và có khả năng di chuyển khác nhau dưới tác dụng của điện trường ⇒ Tính chất này gọi là tính điện di của amino acid.
- Tính điện di của amino acid là khả năng di chuyển khác nhau trong điện trường tùy thuộc vào pH của môi trường.
3. Phản ứng ester hóa
- Tương tự carboxylic acid, amino acid có thể tác dụng với alcohol tạo ester khi có mặt xúc tác acid mạnh (HCl khan, H2SO4 đặc, …)
H2N – CH2 – COOH + C2H5OH H2N – CH2 – COOC2H5 + H2O
Thực tế ester sinh ra dưới dạng muối do NH2 tác dụng với HCl: ClH3N – CH2 – COOC2H5.
Chủ đề 3: Peptide, Protein và Enzyme
* Hệ thống lý thuyết
I. PEPTID
1. Khái niệm và đặc điểm cấu tạo
♦ Khái niệm
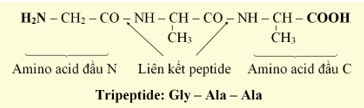
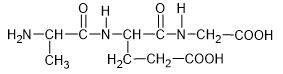
- Peptide là những hợp chất hữu cơ được cấu tạo nên từ các đơn vị α – amino acid liên kết với nhau qua liên kết peptide.
- Liên kết peptide là liên kết CO – NH giữa hai đơn vị α – amino acid.
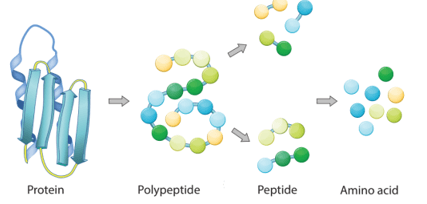
- Các peptide chứa từ 2, 3, 4, … đơn vị α – amino acid lần lượt được gọi là dipeptide, tripeptide, tetrapeptide, … Peptide chứa nhiều đơn vị α – amino acid được gọi là polypeptide.
♦ Cấu tạo
- Theo quy ước, mỗi peptide mạch hở bắt đầu bằng amino acid đầu N (chứa NH2) và kết thúc bằng amino acid đầu C (chứa COOH).
- Tên viết tắt của peptide gồm tên viết tắt của các amino acid theo thứ tự từ amino acid đầu N đến amino acid đầu C.
2. Tính chất hóa học
(a) Phản ứng thủy phân
- Peptide bị thủy phân bởi acid, base hoặc enzyme.
+ Thủy phân không hoàn toàn tạo thành peptide nhỏ hơn.
+ Thủy phân hoàn toàn tạo thành các amino acid, trong môi trường acid hoặc base thì amino acid sẽ phản ứng với môi trường tạo thành muối tương ứng.
H2N – CH2 – CO – NH – CH2 – COOH + H2O 2H2N – CH2 – COOH
H2N – CH2 – CO – NH – CH2 – COOH + H2O + 2HCl 2ClH3N – CH2 – COOH
H2N – CH2 – CO – NH – CH2 – COOH + 2NaOH 2H2N – CH2 – COONa + H2O
(b) Phản ứng màu biuret
♦ Thí nghiệm về phản ứng màu biuret của peptide
- Bước 1: Cho khoảng 1 mL dung dịch NaOH 30% vào ống nghiệm, nhỏ thêm 2 – 3 giọt dung dịch CuSO4 2%, lắc đều.
- Bước 2: Cho khoảng 4 mL dung dịch lòng trắng trứng (polypeptide) vào ống nghiệm, lắc đều.
- Hiện tượng: Xuất hiện kết tủa xanh lam, sau đó kết tủa tan ra tạo thành hợp chất màu tím.
- Các peptide có từ hai liên kết peptide trở lên có phản ứng với Cu(OH)2 trong môi trường kiềm (thuốc thử biuret) tạo thành phức chất màu tím đặc trưng. Phản ứng này gọi là phản ứng màu biuret dùng để nhận biết các peptide (trừ dipeptide).
II. PROTEIN
1. Khái niệm và đặc điểm cấu tạo
- Khái niệm: Protein là hợp chất cao phân tử được hình thành từ một hay nhiều chuỗi polypeptide.
- Phân loại:
+ Protein đơn giản: Thành phần cấu tạo chỉ chứa các đơn vị α – amino acid. VD: insulin, albumin (lòng trắng trứng), fibroin (tơ tằm), …
- Protein phức tạp: Gồm protein đơn giản liên kết với thành phần “phi protein” như nucleic acid, lipid, carbohydrate, …
2. Tính chất vật lí
- Protein hình sợi như keratin (tóc, móng), collagen (da, sụn), fibroin, … không tan trong nước.
- Protein hình cầu như hemoglobin (máu), albumin (lòng trắng trứng), … có thể tan trong nước tạo thành dung dịch keo.
3. Tính chất hóa học
(a) Phản ứng thủy phân
- Tương tự peptide, protein bị thủy phân trong môi trường acid, base hoặc nhờ xúc tác enzyme.
- Quá trình thủy phân trải qua nhiều giai đoạn và khi thủy phân hoàn toàn thì thu được α – amino acid
(b) Phản ứng màu
♦ Phản ứng màu biuret
- Protein chứa nhiều liên kết peptide nên dung dịch protein có phản ứng màu biuret với Cu(OH)2 trong môi trường kiềm tạo hợp chất có màu tím đặc trưng tương tự peptide.
♦ Phản ứng màu với nitric acid
♦ Thí nghiệm về phản ứng màu của protein với nitric acid
- Bước 1: Lấy khoảng 2 mL lòng trắng trứng vào ống nghiệm.
- Bước 2: Thêm tiếp 2 mL dung dịch HNO3, lắc đều hỗn hợp sau đó để yên trong 1 – 2 phút.
- Hiện tượng: Xuất hiện chất rắn màu vàng (do có phản ứng nitro hóa vòng thơm trong protein).
- Protein có phản ứng với dung dịch HNO3 tạo hợp chất rắn có màu vàng.
(c) Phản ứng đông tụ
♦ Thí nghiệm phản ứng đông tụ của protein
- Bước 1: Cho 2 mL dung dịch lòng trắng trứng vào ống nghiệm.
- Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồn trong 2 – 3 phút.
- Hiện tượng: Lòng trắng trứng bị đông tụ lại.
- Protein có thể bị đông tụ dưới tác dụng của nhiệt, acid, base hoặc ion kim loại nặng, sự đông tụ này xảy ra do cấu tạo ban đầu của protein bị biến đổi.
4. Vai trò của protein với sự sống
- Protein rất cần thiết cho sự sống như tham gia xây dựng tế bào, vận chuyển các chất trong cơ thể, điều hòa quá trình trao đổi chất, xúc tác cho quá trình sinh hóa, chống lại các tác nhân gây bệnh, …
- Protein còn là một trong những nguồn thức ăn chính bổ sung năng lượng và các amino acid thiết yếu.
III. ENZYME
1. Vai trò của enzyme trong phản ứng sinh hóa
- Phần lớn enzyme là những protein xúc tác cho các phản ứng hóa học và sinh hóa.
- Xúc tác enzyme thường có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hay một số phản ứng sinh hóa nhất định.
- Tốc độ phản ứng có xúc tác enzyme thường nhanh hơn rất nhiều lần so với xúc tác hóa học.
2. Ứng dụng của enzym trong công nghệ sinh học
- Enzyme có nhiều ứng dụng trong công nghệ sinh học như:
+ Công nghiệp thực phẩm: Sản xuất, bảo quản, chế biến thực phẩm như sữa, bánh mì, rượu, …
+ Y học, dược phẩm: Sản xuất enzyme thay thế, enzyme vận chuyển thuốc hoặc định lượng, định tính và chẩn đoán trong các xét nghiệm, …
+ Kỹ thuật di truyển: Tạo thông tin di truyền mới hoặc sửa đổi thông tin di truyền hiện có, …
+ Hóa học: Xúc tác cho phản ứng, thuốc thử trong hóa học phân tích, …
* Bài tập tự luận
Câu 1. [CTST - SGK] Valine là một amino acid, valine tham gia vào nhiều chức năng của cơ thể, thúc đẩy quá trình phát triển cơ và phục hồi mô. Thiếu valine sẽ ảnh hưởng đến sự phát triển của cơ thể, gây trở ngại về thần kinh, thiếu máu.
(a) Viết phương trình hoá học chứng minh tính lưỡng tính của valine.
(b) Viết công thức cấu tạo của dipeptide Val - Val.
Câu 2. [CD - SGK] Viết cấu tạo của các phân tử peptide được hình thành do sự kết hợp trong các trường hợp sau và gọi tên viết tắt của peptit đó:
(a) 2 phân tử alanine với nhau
(b) 1 phân tử glycine với 1 phân tử alanine
(c) 1 phân tử alanine với 2 phân tử glycine.
Câu 3. [CD - SGK] Cho peptide A có công thức cấu tạo Ala-Gly-Val.
(a) A thuộc loại peptide nào (dipeptide, tripeptide, tetrapeptide)?
(b) Viết phương trình hóa học của phản ứng thủy phân hoàn toàn peptide A bằng dung dịch NaOH dư.
Câu 4. [CTST - SGK] Một peptide có cấu trúc như sau:
(a) Peptide trên chứa các amino acid nào? Có bao nhiêu lên kết peptide trong phân tử?
(b) Viết phản ứng thuỷ phân hoàn toàn peptide đã cho trong dung dịch HCl dư và dung dịch NaOH dư.
(c) Peptide này có phản ứng màu biuret không?
Câu 5. [CTST - SGK]
(a) Khi ăn các loại thực phẩm như thịt, cá, trứng,... hệ tiêu hoá giúp chuyển hoá protein thành amino acid. Cho biết quá trình chuyển hoá trên thuộc loại phản ứng nào?
(b) Khi chế biến một số loại thực phẩm từ thịt, cá, ... người ta có thể thêm gia vị chua như giấm ăn, chanh hoặc vài lát dứa (thơm),... Theo em cách làm trên có tác dụng gì?
(c) Bromelain và papain là những enzyme có tác dụng thủy phân protein. Bromelain có nhiều trong quả dứa (thơm) còn papain có nhiều trong quả đu đủ. Giải thích vì sao thịt được ướp với ép dứa hoặc đu đủ khi nấu sẽ nhanh mềm hơn
Câu 6. [CD - SGK]
(a) Tìm hiểu cách làm nước mắm và cho biết yếu tố nào đã được sử dụng để thực hiện quá trình chuyển hóa protein có trong thịt cá thành các amino acid.
(b) Thành phần tạo nên vị ngọt đặc trưng của nước mắm (được sản xuất từ cá) và nước tương (được sản xuất từ đậu nành) là các amino acid tạo thành từ sự thuỷ phân hoàn toàn của protein có trong cá hoặc đậu nành. Tìm hiểu và cho biết độ đạm của nước tương, nước mắm tương ứng với thành phần nào có trong nước tương, nước mắm. Độ đạm có tỉ lệ thuận với hàm lượng amino acid có trong nước tương, nước mắm không? Giải thích.
Câu 7. [CD - SGK] Protein cũng có thể bị đông tụ bởi ethanol. Tìm hiểu và cho biết:
(a) Vì sao dùng cồn xoa vào tay có thể hạn chế lây nhiễm SARS-CoV-2 qua đường tiếp xúc?
(b) Tìm hiểu và cho biết vì sao trong y tế thường dùng cồn 70o để sát khuẩn mà không dùng cồn 90o.
Câu 8. [CD - SGK] Casein là loại protein chủ yếu có trong sữa.
(a) Dự đoán casein là loại protein tan hay không tan trong nước .
(b) Vì sao uống sữa giúp giảm bớt nguy hiểm khi bị ngộ độc bởi muối chì, muối thủy ngân.
(c) Tìm hiểu cách làm sữa chua và cho biết yếu tố nào đã tạo nên độ đặc của sữa chua.
Câu 9. [KNTT - SGK] Viết ba phương trình hóa học minh họa cho phản ứng có enzyme làm xúc tác mà em đã học.
Câu 10. Các phát biểu sau đúng hay sai? Nếu sai hãy giải thích.
(1) Các peptide mà phân tử chứa nhiều đơn vị α-amino acid được gọi là polypeptide.
(2) Cho Cu(OH)2 vào dung dịch lòng trắng trứng thấy xuất hiện màu vàng.
(3) Tripeptide Gly-Ala-Gly có phản ứng màu biuret.
(4) Liên kết peptide là liên kết –CO–NH– giữa hai đơn vị α -amino acid.
(5) Peptide bị thủy phân trong môi trường acid, base hoặc xúc tác enzyme.
(6) Ở điều kiện thường các protein đều là chất rắn, nhiệt độ nóng chảy cao và dễ tan trong nước.
(7) Peptide mạch hở phân tử chứa hai liên kết peptide CO – NH được gọi là dipeptide.
(8) Trong 1 phân tử tetrapeptide mạch hở có 4 liên kết peptide.
(9) H2N-CH2-CH2-CO-NH-CH2-COOH là một dipeptide.
(10) Hiện tượng thịt cua nổi lên khi nấu canh cua là hiện tượng đông tụ protein.
(11) Các peptide đều tác dụng với Cu(OH)2 cho hợp chất có màu tím đặc trưng
(12) Các hợp chất peptide kém bền trong môi trường base nhưng bền trong môi trường acid.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 12 các chương hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

