Lý thuyết về các hợp chất quan trọng của nhôm (hay, chi tiết)
Bài viết Lý thuyết về các hợp chất quan trọng của nhôm hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm về các hợp chất quan trọng của nhôm.
Lý thuyết về các hợp chất quan trọng của nhôm (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
I. Nhôm oxit: Al2O3
1. Tính chất vật lý
+ Màu trắng, bền với nhiệt, không nóng chảy.
+ Không tác dụng với nước, không tan trong nước.
2. Tính chất hóa học
+ Là oxit lưỡng tính: phản ứng với kiềm nóng chảy và dung dịch axit:
Al2O3 + 2NaOH + 3H2O → Na[(Al(OH)4]
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Vì rất bền nên Al2O3 rất khó bị khử thành kim loại: Khử Al2O3 bằng C không cho Al mà thu được Al4C3:
Al2O3 + 9C → Al4C3 + 6CO
+ Al2O3 không tác dụng với H2, CO ở bất kì nhiệt độ nào.
3. Ứng dụng
+ Điều chế đá quý nhân tạo
+ Tinh thể Al2O3 còn được dùng để chế tạo các chi tiết trong các ngành kĩ thuật chính xác như chân kính đồng hồ, thiết bị phát tia laze,...
+ Bột Al2O3 có độ cứng cao (emeri) được dùng làm vật liệu mài.
+ Phần chủ yếu nhôm oxit được dùng để điều chế nhôm.
+ Ngoài ra, Al2O3 còn được dùng làm vật liệu chịu lửa: chén nung, ống nung và lớp lót trong các lò điện. Nhôm oxit tinh khiết còn được dùng làm ximăng tram răng.
4. Điều chế: Trong công nghiệp, Al2O3 được điều chế bằng cách nung Al(OH)3 ở nhiệt độ cao 1200 – 1400oC:
2Al(OH)3 → Al2O3 + 3H2O
II. Nhôm hydroxit: Al(OH)3
1. Tính chất vật lý
+ Là hợp chất màu trắng, kết tủa keo, không tan trong nước, không bền nhiệt.
2. Tính chất hóa học
+ Dễ bị nhiệt phân thành nhôm oxit:
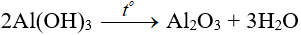
+ Là hợp chất lưỡng tính, tan trong axit và bazơ:
Al(OH)3 + 3H+ → Al3+ + 3H2O
Al(OH)3 + OH- → [(Al(OH)4]-
Ví dụ:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
3. Điều chế
Cho muối Al3+ phản ứng với dung dịch NH3 hoặc muối Na2CO3
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Hoặc từ muối NaAlO2:
2NaAlO2 + CO2 + 3H2O → 2Al(OH)3↓ + Na2CO3
NaAlO2 + CH3COOH + H2O → Al(OH)3↓ + CH3COONa
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
III. Nhôm sunfat và phèn chua
- Nhôm sunfat Al2SO4 là chất bột màu trắng, bị phân hủy nhiệt trên 770oC. Nhôm sunfat kết hợp với kim loại kiềm tạo thành loại muối gọi là phèn nhôm, mà quan trọng nhất là phèn chua K2SO4.Al2SO4.24H2O.
- Phèn chua có dạng tinh thể, không màu, có vị hơi chua và chát.
- Phèn chua được dùng nhiều trong công nghiệp giấy, nhuộm, thuộc da và làm trong nước. Những công dụng này đều xuất phát từ sự thủy phân khá mạnh trong nước của muối nhôm tạo thành aluminum hydroxide:
KAl(SO4)2.12H2O → K+ + Al3+ + 2SO42- + 12H2O
Al3+ + 3H2O ↔ Al(OH)3↓ + 3H+
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 12 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Kim loại kiềm
- Lý thuyết Kim loại kiềm thổ
- Lý thuyết Nhôm
- Dạng 1: Tính chất chung của kim loại kiềm, kiềm thổ, nhôm
- Dạng 2: Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

