FeS + HCl → FeCl2 + H2S | FeS ra H2S
Phản ứng FeS + HCl ra H2S thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về FeS có lời giải, mời các bạn đón xem:
FeS +2HCl → FeCl2 + H2S ↑
1. Phương trình hoá học của phản ứng FeS tác dụng với HCl
FeS + 2HCl → FeCl2 + H2S↑
2. Điều kiện của phản ứng FeS tác dụng với HCl
- Phản ứng diễn ra ở ngay điều kiện thường.
3. Hiện tượng của phản ứng FeS tác dụng với HCl
- FeS tan dần, thoát ra khí không màu, mùi trứng thối.
4. Phương trình ion thu gọn của phản ứng FeS tác dụng với HCl
Bước 1: Viết phương trình phân tử:
FeS + 2HCl → FeCl2 + H2S↑
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; Các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử ta được phương trình ion đầy đủ:
FeS + 2H+ + 2Cl- → Fe2+ + 2Cl- + H2S↑
Bước 3: Lược bỏ đi các ion giống nhau ở 2 vế ta được phương trình ion rút gọn:
FeS + 2H+ → Fe2+ + H2S↑
5. Mở rộng kiến thức về muối sunfua
- Muối sunfua của các kim loại nhóm IA, IIA (trừ Be) như Na2S, K2S tan trong nước và tác dụng với các dung dịch axit HCl, H2SO4 loãng sinh ra khí H2S.
Ví dụ:
Na2S + 2HCl → 2NaCl + H2S↑
- Muối sunfua của một số kim loại nặng như PbS, CuS … không tan trong nước, không tác dụng với dung dịch HCl, H2SO4 loãng.
- Muối sunfua của những kim loại còn lại như ZnS, FeS … không tan trong nước, nhưng tác dụng với dung dịch HCl, H2SO4 loãng sinh ra khí H2S:
ZnS + H2SO4 → ZnSO4 + H2S↑
- Một số muối sunfua có màu đặc trưng: CdS màu vàng; CuS; FeS; Ag2S … màu đen.
6. Kiến thức về hydrochloric acid HCl
6.1. Tính chất vật lí
- Hiđro clorua tan vào nước tạo thành dung dịch hydrochloric acid.
- hydrochloric acid là chất lỏng, không màu, mùi xốc.
- Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
- Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
6.2. Tính chất hóa học
Hydrochloric acid là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với basic oxide và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
6.3. Điều chế
a) Trong phòng thí nghiệm
- Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được hydrochloric acid.
- Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc NaHSO4 + HCl ↑
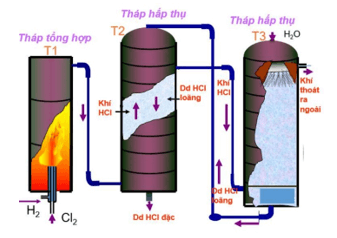
b) Trong công nghiệp
- Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 2HCl
- Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
7. Bài tập vận dụng liên quan
Câu 1:Nung nóng hỗn hợp bột gồm 1,5 mol Fe và 1 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư thu được khí Y. Thành phần của khí Y là
A. H2S.
B. H2.
C. H2S và SO2.
D. H2S và H2.
Hướng dẫn giải:
Đáp án D
Fe + S FeS
Bđ: 1,5 1 mol
Pư: 1dư 0,5 ← 1 → 1 mol
Vậy chất rắn X gồm Fe dư và FeS
⇒ Khí Y gồm H2 và H2S
Câu 2:Nung hỗn hợp X gồm m gam Fe và a gam S ở nhiệt độ cao, sau một thời gian thu được chất rắn Y. Cho Y vào dung dịch HCl dư thu được 2,688 lít hỗn hợp khí Z và còn lại một chất rắn không tan. Giá trị của m là
A. 11,20
B. 6,72
C. 5,60
D. 22,40
Hướng dẫngiải
Đáp án B
Ta có: nZ = 0,12 mol
Bảo toàn nguyên tố H:
→ nHCl = 0,24 mol
Bảo toàn nguyên tố Cl:
Bảo toàn nguyên tố Fe:
→mFe = 6,72g
Câu 3: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Gía trị của m là:
A. 33,6 gam
B. 38,4 gam
C. 3,36 gam
D. 3,84 gam
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng:
H2S + CuSO4 →CuS↓+ H2SO4.
Ta có:
⇒ H2S dư và CuSO4 hết.
Câu 4: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 94%.
B. 6%
C. 60%
D. 40%
Hướng dẫn giải:
Đáp án A
Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X.
Phương trình phản ứng:
Ta có:
Câu 5:Nung 5,6 gam bột sắt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch hydrochloric acid thu được khí Y. Dẫn khí Y vào V lít dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Gía trị của m là:
A. 9,6 gam
B. 19,2 gam
C. 18,6 gam
D. 28,8 gam
Hướng dẫn giải:
Đáp án D
Phương trình phản ứng:
Fe + S FeS
Zn + S ZnS
FeS + 2HCl FeCl2 + H2S
ZnS + 2HCl ZnCl2 + H2S
H2S + CuSO4 CuS + H2SO4
Ta có:
Câu 6: Hoà tan hoàn toàn m gam hỗn hợp gồm Fe và FeS bằng dung dịch HCl thấy thoát ra 8,96 lít (đkc) hỗn hợp khí X. Dẫn hỗn hợp khí X đi qua dung dịch CuCl2 dư, tạo ra 9,6 gam kết tủa. Giá trị m gam hỗn hợp đã dùng là
A. 16,8 gam.
B. 18,6 gam.
C. 25,6 gam.
D. 26,5 gam.
Hướng dẫn giải:
Đáp án C
Sơ đồ bài toán:
Bảo toàn nguyên tố lưu huỳnh:
Bảo toàn electron:
⇒ nFe = 0,3 mol ⇒ m = 0,3.56 + 0,1.88 = 25,6 gam.
Câu 7. Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
A. 0,3. B. 0,4. C. 0,2. D. 0,1.
Hướng dẫn giải
Đáp án C
nHCl = 0,1.0,02 = 0,002 mol
HCl + NaOH → NaCl + H2O
0,002 → 0,002 mol
Câu 8: Cho 36 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00. B. 0,50. C. 0,75. D. 1,25.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
Theo PTHH: nHCl = 2nFeO = 1mol
Câu 9. Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Hướng dẫn giải
Đáp án B
6HCl + Al2O3 → 2AlCl3 + 3H2O
0,3 → 0,05 mol
= 0,05.102 = 5,1 gam
Câu 10. Cho 5,6 gam một oxit kim loại tác dụng vừa đủ với HCl cho 11,1 gam muối clorua của kim loại đó. Cho biết công thức oxit kim loại?
A. Al2O3. B. CaO. C. CuO. D. FeO.
Hướng dẫn giải
Đáp án B
Gọi công thức oxit là M2Oa
2aHCl + M2Oa → 2MCla + aH2O
Gọi số mol H2O là x (mol)⇒ nHCl = 2x (mol)
Bảo toàn khối lượng: 36,5.2x + 5,6 = 11,1 + 18.x
⇒ x = 0,1 mol
a |
1 |
2 |
3 |
M |
20 |
40 |
60 |
Kết luận |
Loại |
Ca |
Loại |
Câu 11. Cho 30,00 gam hỗn hợp X gồm Fe và FeO phản ứng với dung dịch HCl dư, đến khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc). Khối lượng của FeO trong 30,00 gam hỗn hợp X là
A. 13,2 gam. B. 46,8 gam. C. 16,8 gam. D. 5,6 gam.
Hướng dẫn giải
Đáp án A
2HCl + FeO → FeCl2 + H2O
2HCl + Fe → FeCl2 + H2
Theo PTHH:
nFe = nkhí = 0,3 mol ⇒ mFeO = 30 – 0,3.56 = 13,2 gam.
Câu 12. Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% (D = 1,19g/ml) thu được 0,4 mol khí. Phần trăm về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là
A. 40% và 60%.. B. 45% và 55%.
C. 50% và 50% D. 61,6% và 38,4%.
Hướng dẫn giải
Đáp án D
2HCl + ZnO → ZnCl2 + H2O (1)
2HCl + Zn → ZnCl2 + H2 (2)
Theo PTHH (2):
nHCl (2) = 2.nZn = 0,8 mol ⇒ nHCl (1) = 1,2 – 0,8 = 0,4 mol
mhỗn hợp = 0,4.65 + 0,2.81 = 42,2 gam
Xem thêm các phương trình hóa học hay khác:
- 4FeS + 7O2 → 2Fe2O3 + 4SO2
- FeS + H2SO4 → H2S ↑+ FeSO4
- FeS + 6HNO3 → 2H2O + H2SO4 + 3NO ↑ + Fe(NO3)3
- Phương trình nhiệt phân: FeCO3 → FeO + CO2 ↑
- 4FeCO3 + O22 → 2Fe2O3 + 4CO2 ↑
- FeCO3 + 4HNO3 → 2H2O + NO2 ↑+ Fe(NO3)3+ CO2 ↑
- 2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2↑ + 10H2O
- 4FeS2 + 11O2 2Fe2O3 + 8SO2
- FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
- 2FeS2 + 14H2SO4 → Fe2(SO4)3 + 15SO2↑ + 14H2O
- 2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 2CO2↑ + 4H2O
- FeSO4 + 4HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O
- 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



