Đề thi vào lớp 10 môn Hóa học năm 2026 có đáp án (Tự luận - Trắc nghiệm - Đề 2)
Đề thi vào lớp 10 môn Hóa học
Thời gian: 60 phút
Cho nguyên tử khối của các nguyên tố: C = 12; H = 1; N = 14; P = 31; S = 32; Ca = 40; Mg = 24; Al = 27; Fe = 56; Ag = 108; Zn = 65; Si = 28; Cl = 35,5; Ba = 137.
A. Phần trắc nghiệm
Hãy khoanh tròn vào 1 trong các chữ A, B, C, D phương án chọn đúng.
Câu 1. Bazơ nào sau đây không tan trong nước?
A. NaOH
B. KOH
C. Ca(OH)2
D. Cu(OH)2
Câu 2. Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 (dư) + Ca(OH)2 → Ca(HCO3)2
C. Cu + H2SO4 → CuSO4 + H2
D. Fe + CuSO4 → FeSO4 + Cu
Câu 3. Có các chất sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4
B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4
D. Al, Fe, CO2, H2SO4
Câu 4. Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxi khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu.
B. Fe.
C. Al.
D. Na.
Câu 5. Dãy chất gồm các oxit bazơ là
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
Câu 6. Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là
A. 20,4 g.
B. 1,36 g.
C. 13,6 g.
D. 27,2 g.
Câu 7. Phản ứng nào dưới đây là phản ứng trao đổi ?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 +H2
D. BaCl2+H2SO4 → BaSO4 + 2HCl
Câu 8. Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần.
Câu 9. Có một mẫu bột sắt bị lẫn tạp chất là bột nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng
Câu 10. X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65 %. X là nguyên tố:
A. C.
B. S.
C. N.
D. P.
Câu 11. Trong các công thức hoá học sau, công thức hoá học của chất hữu cơ là
A. CO2.
B. CaCO3.
C. CO.
D. C2H5Cl.
Câu 12. Thuốc thử nào sau đây để nhận ra rượu etylic và axit axetic?
A. Na
B. Na2CO3
C. NaCl
D. KCl
Câu 13. Trong các chất sau chất nào tác dụng với Natri?
A. CH3CH3
B. CH3CH2OH
C. C6H6
D. CH3–O–CH3.
Câu 14. Trong 200 ml dung dịch rượu 450 chứa số ml rượu etylic nguyên chất là:
A. 100ml
B. 150ml
C. 90ml
D. 200ml
Câu 15. Axit axetic không phản ứng được với:
A. NaOH
B. Na2CO3
C. Na
D. CH3COOC2H5
Câu 16. Dãy nào sau đây đều gồm các chất thuộc loại polime?
A. Metan, etilen, tinh bột
B. Vinyl clorua, tinh bột, polietilen
C. Poli (vinyl) clorua, axetilen, polietilen
D. Poli (vinyl) clorua, tinh bột, polietilen
B. Phần tự luận
Câu 1. (2 điểm) Khi đốt hoàn toàn 3 gam một hợp chất hữu cơ A thu được 8,8 gam CO2 và 5,4 gam H2O
a) Trong A có chứa những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Xác định công thức phân tử của A?
c) A có làm mất màu dung dịch brom không?
Câu 2. (2 điểm) Viết các phương trình hóa học để thực hiện sơ đồ chuyển hóa sau (ghi đủ các điều kiện phản ứng, nếu có)
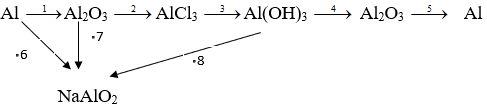
Câu 3. Cho 3,79g hỗn hợp hai kim loại là Zn và Al tác dụng với dung dịch H2SO4 loãng dư, thu được 1792 ml khí (đktc). Tính khối lượng từng kim loại trong hỗn hợp.
Đáp án & Thang điểm
A. Phần trắc nghiệm
Câu 1. D
Cu(OH)2 không tan trong nước.
Câu 2. C
Cu đứng sau H trong dãy hoạt động hóa học do đó Cu không tác dụng được với H2SO4 loãng để giải phóng ra H2.
Câu 3. A
NaOH phản ứng được với Al, CO2, FeSO4, H2SO4.
PTHH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (↑)
CO2 + 2NaOH (dư) → Na2CO3 + H2O
FeSO4 + 2NaOH → Fe(OH)2 (↓) + Na2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
Câu 4. B
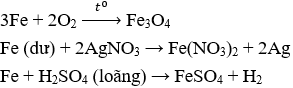
Loại A vì Cu không tác dụng với H2SO4 loãng.
Loại C vì Al tác dụng với H2SO4 loãng thu được muối của kim loại hóa trị III.
Loại D vì Na tác dụng với H2SO4 loãng thu được muối của kim loại hóa trị I.
Câu 5. B
Oxit bazơ là oxit của kim loại và tương ứng với 1 bazơ.
→ CuO, CaO, MgO, Na2O là các oxit bazơ.
Câu 6. C
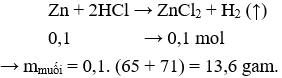
Câu 7. D
Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
→ BaCl2 + H2SO4 → BaSO4 + 2HCl là phản ứng trao đổi.
Câu 8. D
Fe (xám trắng) + CuSO4 (xanh) → Cu (đỏ) + FeSO4 (không màu)
Hiện tượng: có lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần.
Câu 9. A
Sử dụng dung dịch NaOH dư, khi đó bột Al phản ứng hết với NaOH tạo thành dung dịch, còn bột Fe không phản ứng.
2Al + 2NaOH + 2H2O → 2NaAlO2 (dung dịch) + 3H2 (↑)
Lọc lấy chất rắn sau phản ứng, thu được bột Fe tinh khiết.
Câu 10. C
Hợp chất khí với H là XH3.
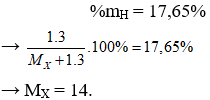
Vậy X là Nitơ (N).
Câu 11. D
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, axit cacbonic, muối cacbonat …
→ C2H5Cl là hợp chất hữu cơ.
Câu 12. B
Sử dụng Na2CO3
+ Có khí thoát ra → axit axetic
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 ↑ + H2O
+ Không có hiện tượng gì → rượu etylic.
Câu 13. B
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2 ↑
Câu 14. C

Câu 15. D
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 ↑ + H2O
2CH3COOH + 2Na → 2CH3COONa + H2 ↑
CH3COOH + CH3COOC2H5 → không phản ứng.
Câu 16. D
Polime là những chất có phân tử khối rất lớn do nhiều mắt xích liên kết với nhau tạo nên.
→ Poli (vinyl) clorua, tinh bột, polietilen thuộc loại polime.
B. Phần tự luận
Câu 1.
a)
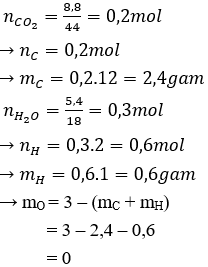
→ A chỉ chứa 2 nguyên tố C và H.
b)
nC : nH = 0,2 : 0,6 = 1 : 3
→ Công thức đơn giản nhất của A: (CH3)n
MA < 40 → 15n < 40 → n < 2,67 → n chỉ có thể là 1 hoặc 2
TH 1: n = 1 → Công thức phân tử của A là CH3 (loại)
TH 2: n = 2 → Công thức phân tử của A là C2H6 (thỏa mãn).
c) C2H6 không làm mất màu dung dịch brom.
Câu 2.
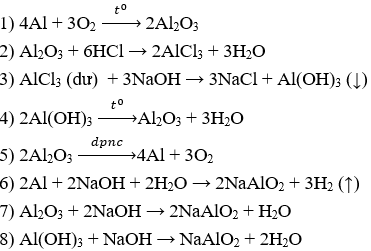
Câu 3.

Xem thêm các Đề ôn thi vào lớp 10 môn Hóa học có đáp án hay khác:
- Đề thi vào lớp 10 môn Hóa học năm 2026 có đáp án (Tự luận - Trắc nghiệm - Đề 1)
- Đề thi vào lớp 10 môn Hóa học năm 2026 có đáp án (Tự luận - Trắc nghiệm - Đề 3)
- Đề thi vào lớp 10 môn Hóa học năm 2026 có đáp án (Tự luận - Trắc nghiệm - Đề 4)
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

