Đề ôn thi vào lớp 10 môn Hóa học năm 2026 (có đáp án) | Đề thi Hóa vào 10
Bộ 50 đề ôn thi vào lớp 10 môn Hóa học năm 2026 có đáp án chi tiết bám sát cấu trúc ra đề thi trắc nghiệm các tỉnh, thành phố Hà Nội, Tp. HCM, Đà Nẵng giúp bạn đạt điểm cao trong kì thi vào lớp 10 môn Hóa.
Đề ôn thi vào 10 môn Hóa năm 2025
Khối không chuyên
Đề thi vào lớp 10 môn Hóa học có đáp án (Trắc nghiệm - Đề 1)
Đề thi vào lớp 10 môn Hóa học có đáp án (Trắc nghiệm - Đề 2)
Đề thi vào lớp 10 môn Hóa học có đáp án (Trắc nghiệm - Đề 3)
Đề thi vào lớp 10 môn Hóa học có đáp án (Trắc nghiệm - Đề 4)
Đề thi vào lớp 10 môn Hóa học có đáp án (Tự luận - Trắc nghiệm - Đề 1)
Đề thi vào lớp 10 môn Hóa học có đáp án (Tự luận - Trắc nghiệm - Đề 2)
Đề thi vào lớp 10 môn Hóa học có đáp án (Tự luận - Trắc nghiệm - Đề 3)
Đề thi vào lớp 10 môn Hóa học có đáp án (Tự luận - Trắc nghiệm - Đề 4)
- Đề tham khảo vào 10 môn Hóa học (5 đề)
- Đề thi vào 10 môn Hóa học Tỉnh Hải Dương năm 2007 - 2009 (10 đề)
- Đề thi vào 10 môn Hóa học Tỉnh Hải Dương năm 2019 - 2020 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề Ôn thi vào 10 (Tự Luận)
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Thời gian: 60 phút
Đề bài:
Câu I : (2,0 điểm) Cho các chất: CuO ; Ag ; NaOH ; Zn ; Na2SO4
1. Những chất nào tác dụng được với dung dịch H2SO4 loãng?
2. Viết các phương trình phản ứng hoá học xảy ra?
Câu II : (2,0 điểm) Viết các phương trình hoá học xảy ra theo chuỗi biến hoá sau, ghi rõ điều kiện phản ứng (nếu có):
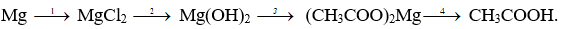
Câu III : (2,0 điểm)
1. Trình bày phương pháp hoá học nhận biết các dung dịch trong các lọ mất nhãn: H2SO4; CH3COOH; BaCl2; NaOH. Viết các phương trình phản ứng hoá học xảy ra (nếu có)
2. Nêu phương pháp làm sạch khí C2H2 bị lẫn các khí CO2 và SO2. Viết các phương trình phản ứng hoá học xảy ra (nếu có).
Câu IV : (2,0 điểm) Hoà tan hoàn toàn 19,5 gam một kim loại M (M có hoá trị II trong hợp chất) dung dịch HCl 1M dư thu được dung dịch A và 6,72 lít khí H2 (ở đktc)
1. Xác định kim loại M.
2. Để trung hoà axit dư trong A cần 200ml dung dịch NaOH 1M. Tính thể tích dung dịch HCl 1M đã dùng.
Câu V : (2,0 điểm) Dẫn 8,96 lít hỗn hợp khí gồm CH4; C2H4; C2H2 vào dung dịch brom dư thấy có 2,24 lít khí thoát ra và có 80,0 gam brom đã tham gia phản ứng.
Tính phần trăm thể tích của mỗi khí trong hỗn hợp ban đầu (biết thể tích các khí đều đo ở cùng đktc)
Cho biết: O = 16; Br = 80; H = 1; C = 12; Mg = 24; Fe = 56; Ca = 40; Ba = 137; Cl = 35,5; Zn = 65.
Đáp án & Thang điểm
Câu I.
1. Những chất tác dụng được với H2SO4 loãng là: CuO; NaOH; Zn.
2. PTHH:
CuO + H2SO4 (loãng) → CuSO4 + H2O
2NaOH + H2SO4 (loãng) → Na2SO4 + 2H2O
Zn + H2SO4 (loãng) → ZnSO4 + H2 (↑).
Câu II.
1. 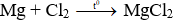
2. MgCl2 + 2NaOH → Mg(OH)2 (↓) + 2NaCl
3. Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
4. (CH3COO)2Mg + Na2CO3 → MgCO3 (↓) + 2CH3COONa.
Câu III.
1.
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím làm thuốc thử:
+ Nếu quỳ tím chuyển sang màu đỏ → H2SO4; CH3COOH (nhóm I)
+ Nếu quỳ tím chuyển sang màu xanh → NaOH
+ Nếu quỳ tím không đổi màu → BaCl2.
- Phân biệt các hóa chất ở nhóm I: Sử dụng BaCl2 vừa nhận ra làm thuốc thử.
+ Nếu có kết tủa trắng xuất hiện → H2SO4
BaCl2 + H2SO4 → BaSO4 (↓ trắng) + 2HCl
+ Nếu không có hiện tượng gì → CH3COOH.
- Dán nhãn các lọ.
2.
Dẫn hỗn hợp khí qua bình đựng nước vôi trong dư; SO2 và CO2 phản ứng bị giữ lại trong bình; C2H2 không phản ứng thoát ra khỏi dung dịch thu được C2H2 tinh khiết.
SO2 + Ca(OH)2 dư → CaSO3 (↓) + H2O
CO2 + Ca(OH)2 dư → CaCO3 (↓) + H2O
C2H2 + Ca(OH)2 → không phản ứng.
Câu IV.

Câu V.
Gọi số mol của CH4; C2H4 và C2H2 lần lượt là x, y và z (mol)
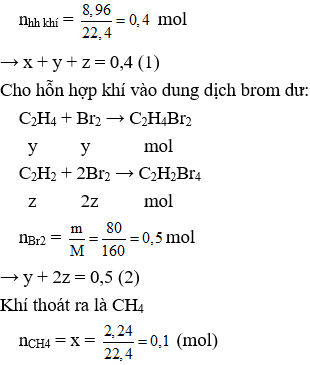
Thay x = 0,1 vào (1) có y + z = 0,3 (3)
Từ (2) và (3) giải hệ phương trình được y = 0,1 và z = 0,2.
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cùng là tỉ lệ về số mol
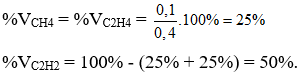
Đề thi vào lớp 10 môn Hóa học (Trắc nghiệm)
Thời gian: 60 phút
Đề bài:
Cho nguyên tử khối của các nguyên tố: C = 12; H = 1; N = 14; S = 32; Ca = 40; Mg = 24; Al = 27; Fe = 56; Ag = 108; Zn = 65; Si = 28; Cl = 35,5; Ba = 137.
Câu 1. Chất tác dụng với nước tạo ra dung dịch bazơ là
A. CO2,
B. K2O.
C. SO2.
D. P2O5
Câu 2. Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là
A. 19,7 g
B. 19,5 g
C. 19,3 g
D. 19 g
Câu 3. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là
A. Zn, Cu, Mg.
B. Zn, Fe, Cu.
C. Mg, Fe, Al.
D. Fe, Zn, Ag.
Câu 4. Thuốc thử để nhận biết ba lọ mất nhãn chứa riêng biệt 3 dung dịch: H2SO4, BaCl2, NaCl là
A. Phenolphtalein.
B. Dung dịch NaOH.
C. Dung dịch Na2CO3.
D. Dung dịch Na2SO4.
Câu 5. Dung dịch NaOH phản ứng được với kim loại
A. Mg
B. Al
C. Fe
D. Cu
Câu 6. Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Câu 7. Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Câu 8. Trộn 2 dung dịch nào sau đây sẽ không xuất hiện kết tủa?
A. BaCl2, Na2SO4
C. Na2CO3, Ba(OH)2
B. BaCl2, AgNO3
D. NaCl, K2SO4
Câu 9. Các muối phản ứng được với dung dịch NaOH là
A. MgCl2, CuSO4
B. BaCl2, FeSO4
C. K2SO4, ZnCl2
D. KCl, NaNO3
Câu 10. Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là
A. 15%.
B. 20%.
C. 18%.
D. 25%
Câu 11. Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là
A. 32,33%
B. 31,81%
C. 46,67%
D. 63,64%
Câu 12. Trong các kim loại sau đây, kim loại có nhiệt độ nóng chảy cao nhất là
A. Vonfam (W).
B. Đồng (Cu).
C. Sắt (Fe)
D. Kẽm (Zn).
Câu 13. Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hiđro là
A. K, Ca
B. Zn, Ag
C. Mg, Ag
D. Cu, Ba
Câu 14. Hoà tan hoàn toàn 32,5 gam một kim loại M (hoá trị II) bằng dung dịch H2SO4 loãng được 11,2 lít khí hiđro (ở đktc). M là
A. Zn
B. Fe
C. Mg
D. Cu
Câu 15. Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam . Vậy khối lượng Ag sinh ra là
A. 10,8 g
B. 21,6 g
C. 1,08 g
D. 2,16 g
Câu 16. Nguyên liệu sản xuất nhôm là quặng
A. Hematit
B. Manhetit
C. Boxit
D. Pirit.
Câu 17. Hòa tan 25,8g hỗn hợp gồm bột Al và Al2O3 trong dung dịch HCl dư. Sau phản ứng người ta thu được 0,6g khí H2. Khối lượng muối AlCl3 thu được là
A. 53,4g
B. 79,6g
C. 80,1g
D. 25,8g.
Câu 18. Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm:
A. Trên 2%
B. Dưới 2%
C. Từ 2% đến 5%
D. Trên 5%
Câu 19. Trong các chất sau,chất nào có tính axit?
A. CH2 = CH2
B. CH2 = CH-CH3
C. CH3 – COOH
D. C2H5OH
Câu 20. Hòa tan hoàn toàn 24 gam CuO vào dung dịch CH3COOH 10%. Khối lượng dung dịch CH3COOH cần dùng là
A. 320 gam
B. 360 gam
C. 380 gam
D. 340 gam
Câu 21. Cho 11,2 lít etilen (đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là:
A. 40%
B. 50%
C. 45%
D. 55%
Câu 22. Đường mía là loại đường nào sau đây?
A. Fructozơ
B. Glucozơ
C. Mantozơ
D. Saccarozơ
Câu 23. Lên men 1 lít ancol etylic 23 độ thu được giấm ăn. Biết hiệu suất lên men là 100% và khối lượng riêng của ancol etylic là 0,8 gam/ml. Khối lượng axit axetic trong giấm là bao nhiêu?
A. 140 gam.
B. 240 gam.
C. 280 gam.
D. 160 gam.
Câu 24. Tính chất vật lí của phi kim là
A. Dẫn điện tốt
B. Dẫn nhiệt tốt
C. Dẫn nhiệt, dẫn điện kém
D. Chỉ tồn tại ở trạng thái khí
Câu 25. Phương trình hóa học điều chế nước Gia - ven là
A. Cl2 + NaOH → NaCl + HClO
B. Cl2 + NaOH → NaClO + HCl
C. Cl2 + H2O → HCl + HClO
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 26. Dãy các hợp chất nào sau đây là hợp chất hữu cơ ?
A. CH4, C2H6, CO2.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO.
D. C2H2, C2H6O, CaCO3.
Câu 27. Hãy cho biết chất nào sau đây trong phân tử chỉ có liên kết đơn ?
A. C6H6.
B. C2H4.
C. CH4.
D. C2H2.
Câu 28. Khí etilen không có tính chất hóa học nào sau đây ?
A. Phản ứng cháy với khí oxi.
B. Phản ứng trùng hợp.
C. Phản ứng cộng với dung dịch brom.
D. Phản ứng thế với clo ngoài ánh sáng.
Câu 29. Chất có liên kết ba trong phân tử là
A. metan.
B. etilen.
C. axetilen.
D. benzen.
Câu 30. Dẫn 0,1 mol khí axetilen qua dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam.
B. 20,0 gam.
C. 26,0 gam.
D. 32,0 gam.
Câu 31. Hoá chất nào sau đây dùng để phân biệt 2 chất CH4 và C2H4?
A. Dung dịch brom.
B. Dung dịch phenolphtalein.
C. Quì tím.
D. Dung dịch bariclorua.
Câu 32. Thực hiện phản ứng este hóa 23g rượu etylic với axit axetic dư, hiệu suất phản ứng 30%. Khối lượng etyl axetat tạo thành là
A. 13,2g
B. 26,4g
C. 36,9g
D. 146,67g
Câu 33. Thủy phân CH3COOCH3 trong môi trường KOH thu được
A. CH3COOK và CH3OH
B. CH3COOH và C2H5OH
C. CH3COOK vàC2H5OH
D. CH3COOK và CH4
Câu 34. Đốt cháy hoàn toàn m gam một hiđrocacbon thu được 44 gam CO2 và 18 gam H2O. Giá trị của m là
A. 11.
B. 12.
C. 13.
D. 14.
Câu 35. Khối lượng CO cần dùng để khử 1,6 gam CuO tạo thành CO2 là
A. 0,56 gam.
B. 1,4 gam.
C. 1,12 gam.
D. 3,6 gam.
Câu 36. Có thể phân biệt xenlulozơ với tinh bột nhờ phản ứng
A. với axit H2SO4.
B. với kiềm.
C. với dd iôt.
D. thuỷ phân.
Câu 37. Khái niệm đúng về polime là
A. Polime là hợp chất được tạo thành từ các phân tử lớn
B. Polime là hợp chất được tạo thành từ các phân tử có phân tử khối nhỏ hơn
C. Polime là sản phẩm duy nhất của phản trùng hợp hoặc trùng ngưng
D. Polime là hợp chất cao phân tử gồm n mắt xích tạo thành
Câu 38. Cho các dung dịch: H2SO4, KCl, Ca(OH)2, Ba(NO3)2. Dung dịch Na2CO3 phản ứng với
A. hai chất.
B. bốn chất.
C. ba chất.
D. một chất.
Câu 39. Dẫn 1,5 mol khí CO2 từ từ đến hết vào dung dịch chứa 1,8 mol KOH thu được dung dịch có chứa chất tan là
A. KHCO3.
B. KOH và K2CO3.
C. K2CO3.
D. KHCO3 và K2CO3
Câu 40. Cho 2,7g nhôm vào dung dịch axit clohiđric dư. Thể tích khí hiđro thoát ra (đktc) là
A. 3,36l
B. 2,24l
C. 6,72l
D. 4,48l
Đáp án & Thang điểm
Câu 1. B
Oxit bazơ tác dụng với nước tạo thành dung dịch bazơ.
K2O + H2O → 2KOH.
Câu 2. A
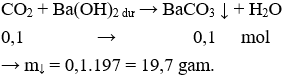
Câu 3. C
H2SO4 loãng phản ứng được với những kim loại đứng trước H trong dãy hoạt động hóa học.
→ Loại A, B và D do Cu và Ag không phản ứng với H2SO4 loãng.
Câu 4. C
Sử dụng dung dịch Na2CO3:
+ Có khí thoát ra → H2SO4
Na2CO3 + H2SO4 → Na2SO4 + CO2 ↑ + H2O
+ Có kết tủa trắng xuất hiện → BaCl2
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
+ Không có hiện tượng → NaCl
Câu 5. B
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
Câu 6. D.
Sử dụng dung dịch H2SO4, có kết tủa trắng xuất hiện → Ba(OH)2; không có hiện tượng gì → NaOH.
2NaOH + H2SO4 → Na2SO4 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O
Câu 7. C
3KOH + FeCl3 → Fe(OH)3 (↓ đỏ nâu) + 3KCl
Câu 8. D
BaCl2 + Na2SO4 → 2NaCl + BaSO4 ↓
BaCl2 + 2AgNO3 → 2AgCl ↓ + Ba(NO3)2
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3 ↓
NaCl + K2SO4 → không phản ứng.
Câu 9. A
MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
Câu 10. B
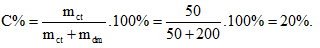
Câu 11. C
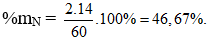
Câu 12. A
Vonfam có nhiệt độ nóng chảy cao nhất.
Câu 13. A
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Câu 14. A
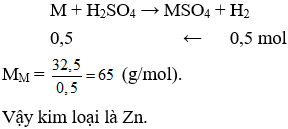
Câu 15. D
Fe dư, nên có phản ứng:
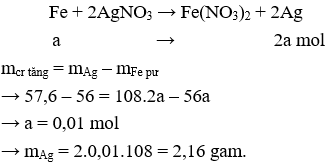
Câu 16. C
Nguyên liệu sản xuất nhôm là quặng boxit.
Câu 17. C
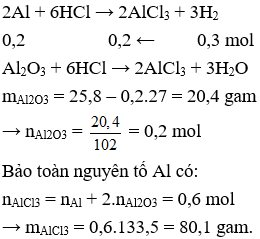
Câu 18. B
Trong thép C chiếm dưới 2%.
Câu 19. C
CH3COOH là axit hữu cơ.
Câu 20. B
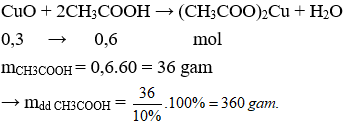
Câu 21. A
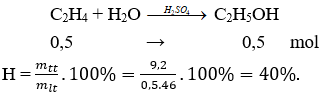
Câu 22. D
Đường mía là đường saccarozơ.
Câu 23. A
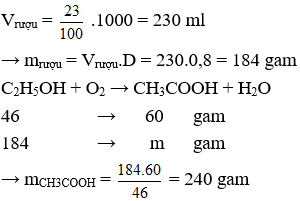
Câu 24. C
Phi kim dẫn điện, dẫn nhiệt kém.
Câu 25. D
Nước gia - ven được điều chế bằng cách cho Cl2 tác dụng với dung dịch NaOH ở điều kiện thường.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Câu 26. B
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, axit cacbonic, muối cacbonat …
→ C6H6, CH4, C2H5OH là các hợp chất hữu cơ.
Câu 27. C
Hợp chất trong phân tử chỉ chứa liên kết đơn là CH4
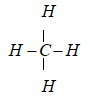
Câu 28. D
Khí etilen không tham gia phản ứng thế với clo ngoài ánh sáng.
Câu 29. C
Axetilen: CH ≡ CH.
Câu 30. D
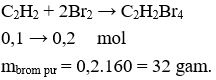
Câu 31. A
C2H4 làm mất màu dung dịch brom còn CH4 thì không làm mất màu dung dịch brom.
Câu 32. A
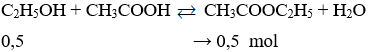
Khối lượng este tạo thành là: 0,5.88.30% = 13,2 gam.
Câu 33. A
CH3COOCH3 + KOH → CH3COOK + CH3OH
Câu 34. D
m = mC + mH = 12.nCO2 + 2.nH2O = 12.1 + 2.1 = 14 gam.
Câu 35. A
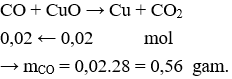
Câu 36. C
Iot làm xanh hồ tinh bột còn xenlulozơ thì không.
Câu 37. D
Câu 38. C
Các phản ứng xảy ra:
H2SO4 + Na2CO3 → Na2SO4 + CO2 (↑) + H2O
Ca(OH)2 + Na2CO3 → CaCO3 (↓) + 2NaOH
Ba(NO3)2 + Na2CO3 → BaCO3 (↓) + 2NaNO3
Câu 39. D
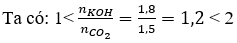
Vậy sau phản ứng thu được hai muối là KHCO3 và K2CO3.
Câu 40. A
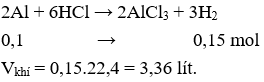
Phòng Giáo dục và Đào tạo .....
Đề Ôn thi vào 10 (Trắc Nghiệm)
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Đề bài:
Cho nguyên tử khối của các nguyên tố: C = 12; H = 1; N = 14; S = 32; Ca = 40; Mg = 24; Al = 27; Fe = 56; Ag = 108; Zn = 65.
Câu 1. Dãy các kim loại được xếp theo chiều mức độ hoạt động hóa học tăng dần từ trái sang phải là
A. Fe, Cu, Al.
B. Cu, Fe, Al.
C. Al, Fe, Cu.
D. Cu, Al, Fe.
Câu 2. Trên bề mặt của chậu nước vôi để ngoài không khí thường bao phủ lớp váng màu trắng đục. Lớp váng đó là
A. Ca(HCO3)2.
B. Ca(OH)2.
C. CaCO3.
D. CaO.
Câu 3. Cho 13,6 gam hỗn hợp X gồm axit axetic và rượu etylic được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 80%. Giá trị của m là
A. 7,04g.
B. 8,80g.
C. 10,56g.
D. 11,00g.
Câu 4. Cho 180g dung dịch glucozơ nồng độ 20% tác dụng với dung dịch AgNO3 trong NH3 dư. Biết phản ứng xảy ra hoàn toàn. Khối lượng Ag thu được là
A. 64,8g.
B. 32,4g.
C. 21,6g.
D. 43,2g.
Câu 5. Kim loại X phản ứng với axit HCl tạo muối XCl2. Kim loại X phản ứng với Cl2 tạo muối XCl3. X là
A. Cu.
B. Zn.
C. Al.
D. Fe.
Câu 6. Chất khí nào sau đây được dung làm nhiên liệu cho đèn xì để hàn cắt kim loại?
A. cacbon monooxit.
B. etilen.
C. metan.
D. axetilen.
Câu 7. Trung hòa 200ml H2SO4 nồng độ aM cần vừa đủ 200ml dung dịch NaOH 1M. Giá trị của a là
A. 0,50.
B. 1,20.
C. 0,75.
D. 1,00.
Câu 8. Cho m gam kim loại Mg tác dụng với dung dịch HCl dư. Sau phản ứng cô cạn dung dịch được 19 gam muối khan. Giá trị của m là
A. 9,6.
B. 7,2.
C. 2,4.
D. 4,8.
Câu 9. Công thức chung của tinh bột là
A. C6H12O6.
B. (-C6O10O5-)n.
C. (- C6H12O6 -)n.
D. C12H22O11.
Câu 10. Hiện tượng xảy ra khi nhỏ dung dịch AgNO3 vào ống nghiệm chứa dung dịch KCl là
A. không có hiện tượng gì.
B. xuất hiện kết tủa vàng.
C. xuất hiện kết tủa trắng.
D. xuất hiện kết tủa đen.
Câu 11. Axit clohiđric phản ứng với tất cả các chất nào trong dãy sau?
A. Ca(OH)2, Cu.
B. Fe, Ag.
C. FeCl2, Mg.
D. Fe2O3, Al.
Câu 12. Thuốc thử để nhận biết dung dịch glucozơ và dung dịch rượu etylic là
A. phenolphtalein.
B. Na.
C. Quỳ tím.
D. AgNO3 trong NH3.
Câu 13. Chọn câu đúng trong các câu sau:
A. Metan, benzen đều làm mất màu dung dịch brom.
B. Etilen, benzen đều làm mất màu dung dịch brom.
C. Metan, etilen, axetilen đều làm mất màu dung dịch brom.
D. Etilen, axetilen đều làm mất màu dung dịch brom.
Câu 14. Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là CO2 và SO2. Hóa chất nào sau đây có thể loại bỏ các tạp chất trên?
A. H2O dư.
B. Dung dịch NaCl dư.
C. Dung dịch Ca(OH)2 dư.
D. Dung dịch HCl dư.
Câu 15. Khí nào sau đây không phản ứng với H2O và dung dịch NaOH?
A. Cl2.
B. SO2.
C. CO.
D. CO2.
Câu 16. Dao, cuốc, xẻng bằng thép sau khi sử dụng sẽ giữ được độ bền lâu nếu?
A. Rửa sạch, lau khô.
B. Ngâm trong nước tự nhiên lâu ngày.
C. Ngâm trong nước muối một thời gian.
D. Để trong tự nhiên.
Câu 17. Muối nào sau đây không tan trong nước?
A. K2SO3
B. Na2SO3
C. CuCl2
D. BaSO4.
Câu 18. Đun nóng chất béo trong dung dịch NaOH thu được các sản phẩm là
A. Muối natri của axit axetic và glixerol.
B. Axit axetic và glixerol.
C. Axit béo và glixerol.
D. Muối natri của axit béo và glixerol.
Câu 19. Có 3 dung dịch: NaOH, HCl, NaCl. Bằng một lần thử duy nhất có thể dùng thuốc thử nảo để nhận biết ba dung dịch trên?
A. Dung dịch BaCl2.
B. BaCO3.
C. Phenolphtalein.
D. Quỳ tím.
Câu 20. Cho kim loại đồng vào dung dịch H2SO4 đặc, nóng sẽ xảy ra hiện tượng nào sau đây?
A. Đồng tan, thu được dung dịch không màu và khí không màu, mùi hắc.
B. Đồng tan, thu được dung dịch màu xanh và khí không màu, mùi hắc.
C. Đồng tan, thu được dung dịch không màu và khí không màu, không mùi.
D. Đồng tan, thu được dung dịch màu vàng và khí không màu, mùi hắc.
Câu 21. Cho 9,2 gam rượu etylic tác dụng với Na dư thu được V lít H2 ở đktc. Giá trị của V là
A. 2,24 lít.
B. 4,48 lít.
C. 3,36 lít.
D. 1,12 lít.
Câu 22. Cho các oxit sau: Na2O, FeO, SO2. Những oxit phản ứng được với nước là
A. FeO, SO2.
B. Na2O, SO2.
C. Na2O, FeO.
D. Cả 3 oxit trên.
Câu 23. Cho 12,8 gam kim loại R có hóa trị II tác dụng hết với khí clo tạo thành 27 gam muối. Kim loại R là
A. Mg.
B. Zn.
C. Cu.
D. Ca.
Câu 24. Chất X được sinh ra từ phản ứng thủy phân protein có khối lượng mol phân tử là 89 g/mol. Đốt cháy hoàn toàn 13,35 gam X thu được 19,8 gam CO2; 9,45 gam H2O và 1,68 lít khí N2 ở đktc. X có công thức phân tử là
A. C2H5NO2.
B. C3H7NO2.
C. C3H5NO2.
D. C4H9NO2.
Câu 25. Phân đạm ure có công thức là
A. CO(NH2)2.
B. NaNO3.
C. (NH4)2SO4.
D. NH4NO3.
Câu 26. Cho các dung dịch: HCl, KCl, Ca(OH)2, BaCl2. Dung dịch Na2CO3 phản ứng với
A. hai chất.
B. bốn chất.
C. ba chất.
D. một chất.
Câu 27. Sản phẩm thu được khi cho dung dịch NaOH vào dung dịch FeCl3 là
A. NaCl và Fe(OH)2.
B. NaCl và Fe(OH)3.
C. Fe2O3 và NaCl.
C. Fe(OH)2; Fe(OH)3 và NaCl.
Câu 28. Dẫn 1,5 mol khí CO2 từ từ đến hết vào dung dịch chứa 1,8 mol NaOH thu được dung dịch có chứa chất tan là
A. NaHCO3.
B. NaOH và Na2CO3.
C. Na2CO3.
D. NaHCO3 và Na2CO3
Câu 29. Dẫn khí CO quan m gam bột Fe2O3 nung nóng, sau một thời gian thu được 24 gam chất rắn X và hỗn hợp khí Y. Dẫn khí Y vào dung dịch nước vôi trong dư thu được 30 gam kết tủa. Giá trị của m là
A. 26,4g.
B. 28,8g.
C. 23,2g.
D. 33,6g.
Câu 30. Phương pháp điều chế nhôm trong công nghiệp là
A. điện phân nóng chảy Al2O3.
B. điện phân nóng chảy Al(OH)3.
C. dùng CO khử Al2O3.
D. dùng kim loại Na tác dụng với dung dịch AlCl3.
Câu 31. Cho m gam hỗn hợp Mg, Al và Zn được chia thành hai phần bằng nhau.
- Phần 1. Tác dụng với H2SO4 loãng, dư thu được 5,6 lít khí H2 ở đktc.
- Phần 2. Tác dụng với oxi dư thu được 11,15 gam hỗn hợp các oxit kim loại.
Giá trị của m là:
A. 7,15g.
B. 18,3g.
C. 14,3g.
D. 9,15g.
Câu 32. Các chất X và Y đều là chất rắn màu đen. Bình hấp thụ khí Z chứa Ca(OH)2. Tiến hành thí nghiệm theo hình vẽ:
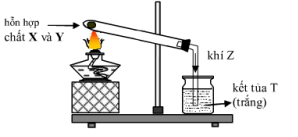
Hỗn hợp các chất X, Y, Z và T là
A. Al2O3, C, CO2 và CaCO3.
B. CuO, C, CO2 và CaCO3.
C. MnO2, KClO3, O2 và CaCO3.
D. CuO, C, CO và CaCO3.
Câu 33. Cho các chất: CH3 –COOH, CH4, C2H6, C2H2, C12H22O11. Dãy chất chỉ gồm các hiđrocacbon là
A. CH3 –COOH, CH4, C2H6, C2H2, C12H22O11.
B. CH3 –COOH, CH4, C2H6, C2H2,
C. CH4, C2H6, C2H2, C12H22O11.
D. CH4, C2H6, C2H2.
Câu 34. Polime nào sau dây không phải là polime thiên nhiên?
A. Poli(vinyl clorua).
B. Xenlulozơ.
C. Protein.
D. Tinh bôt.
Câu 35. Cho sơ đồ phản ứng (chưa cân bằng) sau:
CH3 – COOH + X → CH3COOK + Y
Cặp chất X, Y phù hợp là
A. KOH, H2.
B. K, H2.
C. KCl, HCl.
D. K, H2O.
Câu 36. Cho các oxit sau: CO2, SO2, BaO, Na2O, CO. Dãy gồm các oxit axit là
A. BaO, Na2O, CO.
B. CO2, SO2, CO.
C. CO2, SO2.
D. CO2, SO2, BaO.
Câu 37. Cho 8 gam hỗn hợp gồm Mg và Fe vào dung dịch HCl dư. Phản ứng kết thúc thu được 4,48 lít khí H2 ở đktc. Phần trăm khối lượng của sắt trong hỗn hợp là
A. 70%.
B. 30%.
C. 60%.
D. 40%.
Câu 38. Một dung dịch A có pH = 3. Dung dịch A có môi trường là
A. không xác định được.
B. axit.
C. bazơ.
D. trung tính.
Câu 39. Hiđrocacbon X là chất khí ở điều kiện thường, có khả năng làm mất màu dung dịch nước brom, có tác dụng làm quả xanh mau chín. X là
A. etilen.
B. benzen.
C. metan.
D. axetilen.
Câu 40. Hai chất CH3 – CH2 – OH và CH3 – O – CH3 khác nhau về
A. công thức cấu tạo.
B. số lượng nguyên tử.
C. khối lượng mol phân tử.
D. công thức phân tử.
Đáp án & Thang điểm
Câu 1. B
Dãy hoạt động hóa học của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
→ Chiều mức độ hoạt động hóa học tăng dần từ trái sang phải là: Cu; Fe; Al.
Câu 2. C
Nguyên nhân xuất hiện lớp váng là do:
Ca(OH)2 + CO2 → CaCO3 (↓) + H2O.
Câu 3. A
Gọi số mol của CH3COOH là 3a mol → số mol của CH3CH2OH là 2a mol
mX = 13,6 gam → 60.3a + 46.2a = 13,6 → a = 0,05 mol
PTHH:
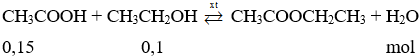
Giả sử hiệu suất là 100% thì rượu etylic hết, nên số mol sản phẩm phản ứng tính theo số mol rượu etylic.
Số mol este là: neste thực tế = neste lý thuyết. H = 0,1.80% = 0,08 mol
→ m = n.M = 0,08.88 = 7,04 gam.
Câu 4. D
Khối lượng glucozơ có trong dung dịch là:
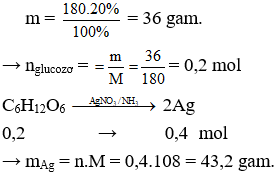
Câu 5. D
Câu 6. D
Khi axetilen cháy trong oxi, nhiệt độ ngọn lửa có thể lên tới 3000°C. Vì vậy axetilen được sử dụng làm nhiên liệu trong đèn xì oxi – axetilen để hàn cắt kim loại.
Câu 7. A
nNaOH = CM.V = 1.0,2 = 0,2 mol;
nH2SO4 = CM.V = 0,2.a mol
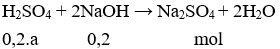
Theo PTHH có: nNaOH = 2.naxit → 0,2 = 2.0,2.a → a = 0,5.
Câu 8. D
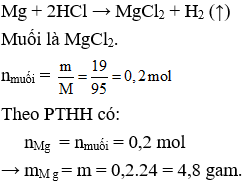
Câu 9. B
Công thức chung của tinh bột là: (-C6O10O5-)n.
Câu 10. C
AgNO3 + KCl → AgCl (↓ trắng) + KNO3.
Câu 11. D
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
2Al + 6HCl → 2AlCl3 + 3H2 (↑)
Câu 12. D
Sử dụng dung dịch AgNO3 trong NH3
+ Có chất màu sáng bạc bám trên thành ống nghiệm → glucozơ.
+ Không hiện tượng → rượu etylic.
Câu 13. D
Etilen, axetilen đều làm mất màu dung dịch brom. PTHH:
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4.
Câu 14. C
Sử dụng dung dịch Ca(OH)2 dư. SO2 và CO2 phản ứng bị giữ lại, còn CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
SO2 + Ca(OH)2 dư → CaSO3 (↓) + H2O
CO2 + Ca(OH)2 dư → CaCO3 (↓) + H2O
Câu 15. C
CO là oxit trung tính nên không tác dụng với H2O và NaOH.
Câu 16. A
Lau chùi sạch sẽ đồ dùng bằng thép sau khi sử dụng sẽ giúp kim loại bị ăn mòn chậm hơn, đồ đạc được bền lâu hơn.
Câu 17. D
BaSO4 không tan trong nước.
Câu 18. D
Đun nóng chất béo trong dung dịch NaOH thu được muối natri của axit béo và glixerol.
Câu 19. D
Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl.
+ Quỳ tím chuyển sang màu xanh → NaOH.
+ Quỳ tím không chuyển màu → NaCl.
Câu 20. B
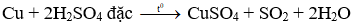
Khí SO2 không màu, mùi hắc. Dung dịch CuSO4 có màu xanh.
Câu 21. A
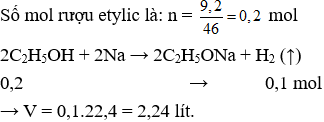
Câu 22. B
Na2O + H2O → 2NaOH
SO2 + H2O ⇄ H2SO3
Câu 23. C
R + Cl2 → RCl2
Bảo toàn khối lượng có: mclo = mmuối – mM = 27 – 12,8 = 14,2 gam
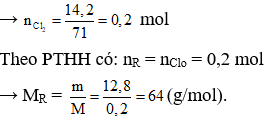
Vậy kim loại R là Cu.
Câu 24. B
Gọi công thức phân tử của X có dạng: CxHyOzNt
Ta có:
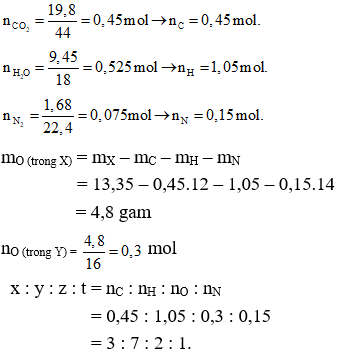
Vậy công thức đơn giản nhất của X là: (C3H7O2N)n
Khối lượng mol phân tử của X là 89 (g/mol) → 89n = 89 → n = 89.
Vậy công thức phân tử của X là C3H7O2N.
Câu 25. A
Đạm ure: CO(NH2)2.
Câu 26. C
Các phản ứng xảy ra:
2HCl + Na2CO3 → 2NaCl + CO2 (↑) + H2O
Ca(OH)2 + Na2CO3 → CaCO3 (↓) + 2NaOH
BaCl2 + Na2CO3 → BaCO3 (↓) + 2NaCl
Câu 27. B
3NaOH + FeCl3 → Fe(OH)3 (↓) + 3NaCl.
Câu 28. D
Ta có: 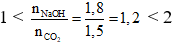
Vậy sau phản ứng thu được hai muối là NaHCO3 và Na2CO3.
Câu 29. B
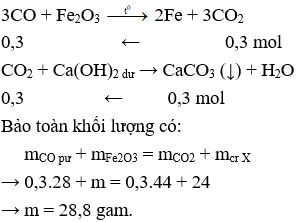
Câu 30. A
Phương pháp điều chế nhôm trong công nghiệp là điện phân nóng chảy Al2O3
Câu 31. A
Gọi số mol của Mg, Al và Fe lần lượt là x, y và z mol
Phần 1:
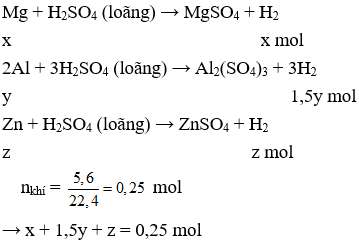
Phần 2:

Câu 32. B
A sai do C không phản ứng được với Al2O3.
C sai do O2 không phản ứng với Ca(OH)2
D sai do CO không phản ứng với Ca(OH)2.
Câu 33. D
CH4, C2H6, C2H2 là các hiđrocacbon.
Câu 34. A
Protein, tinh bột, xenlulozơ là các polime thiên nhiên.
Câu 35. B
2CH3COOH + 2K → 2CH2COOK + H2 (↑)
Câu 36. C
CO2, SO2: oxit axit.
BaO, Na2O: oxit bazơ.
CO: oxit trung tính.
Câu 37. A
Gọi số mol của Mg và Fe lần lượt là x và y (mol)
mhh = 8 gam → 24x + 56y = 8 (1)
PTHH:
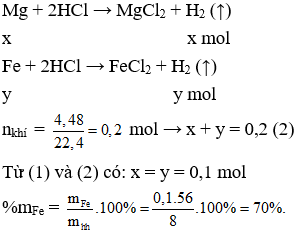
Câu 38. B
pH = 3 < 7 → dung dịch có môi trường axit.
Câu 39. D
Axetilen là chất khí ở điều kiện thường, có khả năng làm mất màu dung dịch nước brom, có tác dụng làm quả xanh mau chín.
Câu 40. A
B sai vì hai chất đều có 2 nguyên tử C, 6 nguyên tử H và 1 nguyên tử O.
C sai vì hai chất đều có khối lượng mol phân tử là 46.
D sai vì hai chất đều có công thức phân tử là C2H6O.
Phòng Giáo dục và Đào tạo .....
Đề Ôn thi vào 10 (Tự Luận - Trắc Nghiệm)
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Cho nguyên tử khối của các nguyên tố: C = 12; H = 1; N = 14; S = 32; Ca = 40; Mg = 24; Al = 27; Fe = 56; Ag = 108; Zn = 65; Si = 28; Cl = 35,5; Ba = 137.
A. Phần trắc nghiệm
Hãy khoanh tròn vào 1 trong các chữ A, B, C, D phương án chọn đúng.
Câu 1. Dãy chất nào dưới đây tác dụng được với dung dịch NaOH?
A. CuO, CuSO4, SO2.
B. Al, Fe2O3, HCl.
C. H2SO4, FeSO4, CO2.
D. KCl, MgSO4, SO2.
Câu 2. Hãy chọn một thuốc thử để phân biệt 3 dung dịch không màu chứa trong 3 lọ bị mất nhãn: BaCl2, Na2CO3, NaCl.
A. dd HCl.
B. dd H2SO4.
C. dd AgNO3.
D. Quỳ tím.
Câu 3. Có thể dùng chất nào sau đây để làm sạch muối AlCl3 có lẫn CuCl2?
A. Zn.
B. Mg.
C. Al.
D. AgNO3.
Câu 4. Để làm khô khí SO2 có lẫn hơi nước – người ta dẫn khí này qua dung dịch?
A. NaOH đặc.
B. H2SO4 đặc.
C. Ca(OH)2 dư.
D. NaCl.
Câu 5. Cho sơ đồ phản ứng:
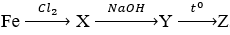
Chất Z có công thức là
A. Fe2O3
B. FeO
C. Fe3O4
D. Fe(OH)2
Câu 6. Để pha loãng dung dịch H2SO4 đặc một cách an toàn phải
A. cho nước từ từ vào axit.
B. đổ nhanh nước vào axit.
C. cho từ từ axit vào nước.
D. đổ thật nhanh axit vào nước.
Câu 7. Chỉ dùng dung dịch NaOH có thể phân biệt được cặp kim loại nào sau đây?
A. Fe, Cu.
B. Al, Fe.
C. Mg, Fe.
D. Fe, Ag.
Câu 8. Hòa tan hoàn toàn 3,25 gam một kim loại M (hóa trị II) bằng dung dịch H2SO4 loãng thu được 1,12 lít khí H2 (ở đktc). Kim loại M là
A. Zn
B. Fe
C. Mg
D. Ca
Câu 9. Biết nguyên tử của nguyên tố X có cấu tạo gồm 3 lớp electron và lớp ngoài cùng có 5 electron. Vậy X thuộc
A. nhóm III, chu kỳ 3.
B. nhóm V, chu kỳ 5.
C. nhóm III, chu kỳ 5.
D. nhóm V, chu kỳ 3.
Câu 10. Hãy chỉ ra những cặp chất có thể làm mất màu dung dịch brom?
A. CH4, C2H4,
B. C2H4, C6H6,
C. C2H4, C2H2,
D. CH4, C6H6.
Câu 11. Pha 8 lít rượu etylic với 12 lít nước thu được dung dịch có độ rượu là
A. 15°
B. 60°
C. 40°
D. 66,66°.
Câu 12. Đốt cháy hoàn toàn một hiđrocacbon X thu được khí CO2 và hơi nước có tỉ lệ số mol là 2 : 1. Vậy công thức của X là
A. C2H4
B. C2H6
C. C3H8
D. C2H2
Câu 13. Để thu được 44,8 lít khí H2 (đktc) thì lượng Na cho phản ứng với rượu etylic dư là
A. 23g.
B. 92g.
C. 46g.
D. 9,2g.
Câu 14. Nhóm chất đều phản ứng với Na là
A. CH3COOH, C6H6
B. C4O10, C2H5OH
C. H2O, C2H5OH
D. C2H5OH, C2H2
Câu 15. Đốt cháy hoàn toàn 40 ml rượu etylic chưa rõ độ rượu thu được 17,92 lít khí CO2 (đktc), (Drượu = 0,8 gam/ml). Vậy rượu etylic có độ rượu là
A. 57,5°
B. 46°
C. 60°
D. 68,5°
Câu 16. Đốt cháy hoàn toàn 2,24 lít hiđrocacbon A thu được 6,72 lít CO2 và 5,4 gam hơi nước (các thể tích khí và hơi đo ở đktc). Công thức phân tử của A là
A. C3H8
B. C4H8
C. C2H4
D. C3H6
B. Phần tự luận
Câu 1. (1,5 điểm)
Viết các PTHH thực hiện các chuyển hóa sau (ghi rõ điều kiện phản ứng, nếu có)
C6H12O6 → C2H5OH → CH3COOH → CH3COOC2H5
Câu 2. (1,5 điểm) Bằng phương pháp hóa học nhận biết 3 khí không màu: C2H4, CO2, CH4 chứa trong các bình mất nhãn.
Câu 3. (3 điểm) Hòa tan hoàn toàn 10,6 gam Na2CO3 vào dung dịch CH3COOH 0,5M.
1. Viết phương trình hóa học xảy ra và gọi tên muối tạo thành.
2. Tính
a/ Thể tích khí thoát ra ở đktc.
b/ Thể tích dung dịch CH3COOH đã phản ứng.
3. Dẫn toàn bộ lượng khí thoát ra ở trên vào bình đựng 1 lít dung dịch NaOH 0,1M. Tính khối lượng muối tạo thành (biết: Na = 23; C = 12).
Đáp án & Thang điểm
A. Phần trắc nghiệm
Câu 1. C
H2SO4 + 2NaOH → Na2SO4 + H2O
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
CO2 + 2NaOH (dư) → Na2CO3 + H2O
Câu 2. B
Sử dụng dung dịch H2SO4:
+ Có kết tủa trắng xuất hiện → BaCl2
H2SO4 + BaCl2 → BaSO4 (↓ trắng) + 2HCl
+ Có khí thoát ra → Na2CO3
H2SO4 + Na2CO3 → Na2SO4 + CO2 ↑ + H2O
+ Không có hiện tượng xuất hiện → NaCl
Câu 3. C
2Al + 3CuCl2 → 2AlCl3 + 3Cu (↓)
Sử dụng một lượng dư Al sẽ làm sạch được muối AlCl3 có lẫn CuCl2.
Câu 4. B
Dung dịch được dùng để làm khô SO2 phải hút nước nhưng không tác dụng với SO2. Vậy H2SO4 đặc thỏa mãn.
Câu 5. A
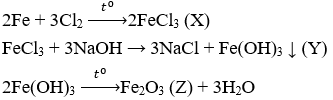
Câu 6. C
Để pha loãng axit sunfuric đặc một cách an toàn phải cho từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh.
Câu 7. B
Dùng dung dịch NaOH có thể phân biệt được hai kim loại Al và Fe.
Hiện tượng:
+ Kim loại tan dần, có khí thoát ra → kim loại Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (↑)
+ Không có hiện tượng gì → kim loại Fe.
Câu 8. A
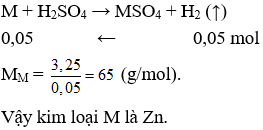
Câu 9. D
X có 3 lớp electron → thuộc chu kỳ 3
X có 5 electron lớp ngoài cùng → thuộc nhóm VA.
Câu 10. C
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
Câu 11. C
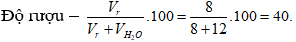
Câu 12. D
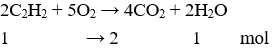
Câu 13. B
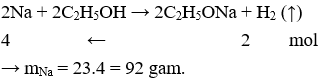
Câu 14. C
2Na + 2H2O → 2NaOH + H2(↑)
2Na + 2C2H5OH → 2C2H5ONa + H2 (↑)
Câu 15. A
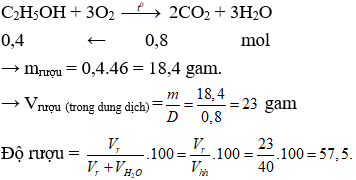
Câu 16. D
Đặt công thức phân tử của A là CxHyOz
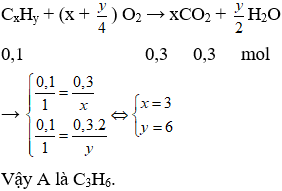
B. Phần tự luận
Câu 1. Mỗi phương trình hóa học 0,5 điểm
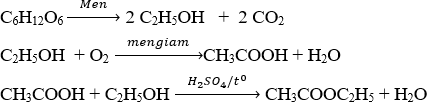
Câu 2.
- Đánh số thứ tự từng bình mất nhãn.
- Dẫn lần lượt từng khí qua ống nghiệm đựng dung dịch brom, nếu dung dịch brom nhạt màu dần đến mất màu → C2H4.
C2H4 + Br2 → C2H4Br2
- Hai khí còn lại không làm mất màu dung dịch brom. Dẫn lần lượt từng khí qua ống nghiệm đựng nước vôi trong.
+ Nếu xuất hiện kết tủa trắng → CO2.
CO2 + Ca(OH)2 (dư) → CaCO3 (↓ trắng) + H2O
+ Không hiện tượng → CH4.
- Dán nhãn từng lọ chứa khí.
Câu 3.
1. Na2CO3 + 2CH3COOH → 2CH3COONa + CO2 (↑) + H2O
Muối tạo thành: CH3COONa: natri axetat.
2. Số mol Na2CO3 là: 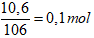

→ Sau phản ứng CO2 và NaOH hết thu được muối NaHCO3
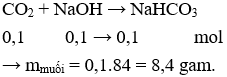
Xem thêm các đề kiểm tra, đề thi các môn học lớp 9 chọn lọc, có đáp án hay khác:
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

