Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 6 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 6: Tốc độ phản ứng hóa học có đáp án chi tiết đầy đủ các mức độ sẽ giúp học sinh lớp 10 ôn luyện trắc nghiệm Hóa học 10.
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 6 (có đúng sai, trả lời ngắn)
Chỉ từ 200k mua trọn bộ Bài tập ôn tập + Đề kiểm tra Hoá học 10 Cánh diều theo Chủ đề theo cấu trúc mới bản word có lời giải chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn.
Câu 1. Tốc độ phản ứng là
A. độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 2. Khi cho cùng một lượng magnesium vào cốc đựng dung dịch acid HCl, tốc độ phản ứng sẽ lớn nhất khi dùng magnesium ở dạng
A. viên nhỏ.
B.bột mịn, khuấy đều.
C. lá mỏng.
D. thỏi lớn.
Câu 3. Phát biểu nào sau đây là đúng?
A. Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương.
B. Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
C. Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
D. Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
Câu 4. Hằng số tốc độ phản ứng k phụ thuộc vào
A. thể tích và bản chất các chất tham gia phản ứng.
B. nhiệt độ và bản chất các chất tham gia phản ứng.
C. tốc độ độ và bản chất các chất tham gia phản ứng.
D. áp suất và bản chất các chất tham gia phản ứng.
Câu 5. Trong các cặp phản ứng sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như nhau thì cặp nào có tốc độ phản ứng lớn nhất?
A. Fe + dung dịch HCl 0,3 M.
B. Fe + dung dịch HCl 0,5 M.
C. Fe + dung dịch HCl 0,1 M.
D. Fe + dung dịch HCl 0,2 M.
Câu 6. Cho phản ứng hóa học sau: Zn (s) + H2SO4 (aq, dư) → ZnSO4 (aq) + H2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt Zn.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
Câu 7. Tốc độ tức thời của phản ứng là
A. tốc độ được tính một khoảng thời gian.
B. sự biến thiên nồng độ.
C. tốc độ được tính tại một thời điểm nhất định.
D. biến thiên khối lượng của phản ứng.
Câu 8. Củi khi được chẻ nhỏ sẽ cháy nhanh và mạnh hơn so với củi có kích thước lớn. Yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng trong trường hợp trên?
A. Chất xúc tác.
B. Diện tích bề mặt tiếp xúc.
C. Nồng độ.
D. Nhiệt độ.
Câu 9. Phản ứng nào sau đây không thay đổi tốc độ khi tăng áp suất?
A. 2H2(g) + O2(g) → 2H2O(l).
B. H2(g) + Cl2(g) → 2HCl(g).
C. CO(g) + 2H2(g) → CH3OH(g).
D. MgO(s) + H2SO4(aq) → MgSO4(aq) + H2O(g).
Câu 10. Cho phản ứng đơn giản: sản phẩm. Khi tăng nồng độ chất A lên gấp đôi, tốc độ phản ứng thay đổi như thế nào?
A. Tăng 2 lần.
B. Tăng 6 lần.
C. Tăng 4 lần.
D. Không đổi.
Câu 11. Xét phản ứng Tốc độ trung bình của sự mất đi của tương ứng với biểu thức nào sau đây?
A.
B.
C.
D.
Câu 12. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) 2NO2(g) có biểu thức tốc độ tức thời: Nếu nồng độ của NO không đổi, nồng độ O2 tăng 3 lần, thì tốc độ sẽ
A. không đổi.
B. tăng 1,5 lần.
C. giảm 2 lần.
D. tăng 3 lần.
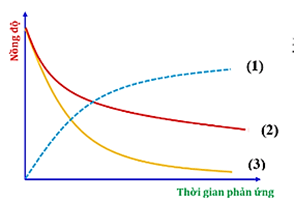
Câu 13. Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước: O2(g) + 2H2(g) 2H2O(g), như sau:
Đường cong nào của hydrogen?
A. Đường cong số (3).
B. Đường cong số (1).
C. Đường cong số (2) hoặc (3) đều đúng.
D. Đường cong số (2).
Câu 14. Cho các biện pháp sau:
(a) Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
(b) Bảo quản thực phẩm trong tủ lạnh để giữ thực phẩm tươi lâu.
(c) Nghiền nguyên liệu trước khi nung để sản xuất clinker.
(d) Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Số biện pháp được sử dụng để tăng tốc độ phản ứng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15. Cho phản ứng:
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng?
A. Chất xúc tác.
B. Nhiệt độ.
C. Kích thước tinh thể KClO3.
D. Áp suất.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu hỏi. Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
a. Phản ứng trong bình 1 có tốc độ thoát khí chậm hơn so với bình 2.
b. Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
c. Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
d. Phản ứng trên thuộc loại phản ứng oxi hóa – khử.
Phần III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
Câu hỏi. Cho các yếu tố có thể ảnh hưởng đến tốc độ phản ứng nói chung như sau:
(1) Đun nóng chất tham gia; (2) Thêm xúc tác phù hợp; (3) Pha loãng dung dịch; (4) Giảm nhiệt độ; (5) Tăng nhiệt độ; (6) Giảm diện tích bề mặt; (7) Tăng nồng độ chất phản ứng; (8) Chia nhỏ chất phản ứng thành mảnh nhỏ.
Có bao nhiêu yếu tố làm tăng tốc độ phản ứng nói chung?
................................
................................
................................
Xem thêm bài tập ôn tập Hóa học lớp 10 Cánh diều có đáp án hay khác:
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 1 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 2 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 3 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 4 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 5 (có đúng sai, trả lời ngắn)
Bài tập ôn tập Hóa học 10 Cánh diều Chủ đề 7 (có đúng sai, trả lời ngắn)
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

