Chuyên đề Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất lớp 12
Tài liệu chuyên đề Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất Hóa học lớp 12 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 12.
Chuyên đề Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất lớp 12
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Chỉ từ 300k mua trọn bộ Chuyên đề dạy thêm Hóa học 12 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chủ đề 1: Đại cương về kim loại chuyển tiếp dãy thứ nhất
A. HỆ THỐNG LÝ THUYẾT
I. Đơn chất kim loại chuyển tiếp dãy thứ nhất
1. Đặc điểm cấu tạo nguyên tử
- Kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29):
|
Nguyên tố |
Số hiệu nguyên tử |
Cấu hình electron |
Số electron hóa trị |
|
Scandium (Sc) |
21 |
[Ar]3d14s2 |
3 |
|
Titanium (Ti) |
22 |
[Ar]3d24s2 |
4 |
|
Vanadium (V) |
23 |
[Ar]3d34s2 |
5 |
|
Chromium (Cr) |
24 |
[Ar]3d54s1 |
6 |
|
Manganese (Mn) |
25 |
[Ar]3d54s2 |
7 |
|
Iron (Fe) |
26 |
[Ar]3d64s2 |
8 |
|
Cobalt (Co) |
27 |
[Ar]3d74s2 |
9 |
|
Nickel (Ni) |
28 |
[Ar]3d84s2 |
10 |
|
Copper (Cu) |
29 |
[Ar]3d104s1 |
11 |
Cấu hình electron của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng: [Ar]3da4sb
(a = 1 → 10, b = 1 → 2)
- Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hóa trị thuộc phân lớp 3d và 4s.
2. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp
- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA, IIA cùng chu kì.
|
Tính chất |
Đặc điểm |
Ứng dụng |
|
Nhiệt độ nóng chảy |
Khó nóng chảy, đặc biệt là V, Cr, Co. |
Chế tạo dụng cụ, máy móc, thiết bị làm việc ở nhiệt độ cao. |
|
Độ cứng |
Khá cao, Cr là kim loại cứng nhất trong tất cả các kim loại. |
Chế tạo hợp kim không gỉ hoặc siêu cứng để sản xuất dụng cụ y tế, nhà bếp, vòng bi, mũi khoan, … |
|
Khối lượng riêng |
Sc và Ti tương đối nhẹ. Các kim loại khác đều là kim loại nặng. |
Chế tạo vật liệu hàng không, gọng kính. Sản xuất phương tiện giao thông, máy móc, bệ máy, … |
|
Độ dẫn điện |
Tương đối tốt, Cu là kim loại dẫn điện tốt (chỉ sau Ag). |
Chế tạo dây dẫn điện, thiết bị điện, … |
|
Độ dẫn nhiệt |
Tương đối tốt, điển hình là Cu |
Chế tạo thiết bị nồi hơi, thiết bị trao đổi nhiệt, đồ gia dụng, … |
II. Hợp chất của kim loại chuyển tiếp dãy thứ nhất
1. Số oxi hóa của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất
- Do có nhiều electron hóa trị nên các nguyên tố kim loại chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau.
- Số oxi hóa phổ biến của một số nguyên tố: Cr (+3, +6), Mn (+2, +4, +7), Fe (+2, +3), Cu (+2).
- Cấu hình electron của một số cation kim loại: Nhường e hết phân lớp 4s sau đó mới đến 3d.
Fe2+: [Ar]3d6 Fe3+: [Ar]3d5 Cr3+: [Ar]3d3 Cu2+: [Ar]3d9
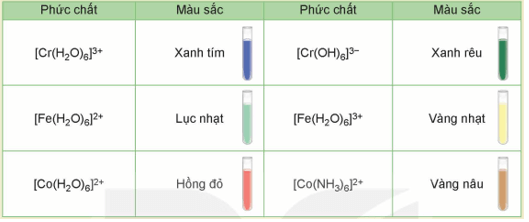
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
- Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu:
3. Thí nghiệm
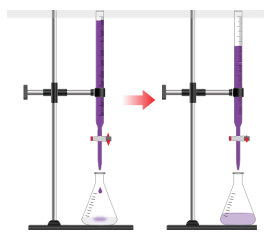
TN1: Chuẩn độ iron(II) sulfate bằng thuốc tím
- Trong phòng thí nghiệm, nồng độ của FeSO4 có thể được xác định bằng phương pháp chuẩn độ với dung dịch KMnO4 trong môi trường H2SO4 theo phương trình:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO + 2MnSO4 + 8H2O
|
♦ Chuẩn bị: - Hóa chất: Các dung dịch KMnO4 0,02 M; H2SO4 10%; FeSO4 nồng độ khoảng 0,1 M. - Dụng cụ: Pipette 5 mL, burette 25 mL, bình tam giác 100 mL, ống đong 10 mL, bình tia nước cất, giá đỡ, kẹp càng cua. ♦ Tiến hành: - Dùng pipette lấy 5,0 mL dung dịch FeSO4 cho vào bình tam giác, thêm tiếp khoảng 5 mL dung dịch H2SO4 10% (lấy bằng ống đong). - Cho dung dịch KMnO4 vào burette, điều chỉnh thể tích dung dịch trong burette về mức 0. - Mở khóa burette, nhỏ từng giọt dung dịch KMnO4 xuống bình tam giác, lắc đều. |
|
Ban đầu dung dịch trong bình tam giác xuất hiện màu hồng rồi mất màu, tiếp tục chuẩn độ đến khi màu hồng tồn tại bền trong khoảng 20 giây thì dừng chuẩn độ.
- Ghi lại thể tích dung dịch KMnO4 đã dùng.
|
Thí nghiệm |
||||
|
1 |
? |
? |
? |
? |
|
2 |
? |
? |
||
|
3 |
? |
? |
TN2: Nhận biết sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch
♦ Chuẩn bị:
- Hóa chất: Các dung dịch FeCl3 1 M; CuSO4 1 M; NaOH 1 M.
- Dụng cụ: Ống nghiệm, kẹp ống nghiệm.
♦ Tiến hành:
- Cho khoảng 2 mL dung dịch FeCl3 1 M vào ống nghiệm (1) và khoảng 2 mL dung dịch CuSO4 1 M vào ống nghiệm (2).
- Thêm tiếp vào mỗi ống nghiệm khoảng 2 – 3 giọt dung dịch NaOH 1 M, lắc nhẹ.
♦ Hiện tượng: Ống nghiệm (1) xuất hiện kết tủa nâu đỏ.
Ống nghiệm (2) xuất hiện kết tủa xanh lam.
❖ BÀI TẬP TỰ LUẬN
Câu 1. (a) Viết cấu hình electron và xác định số electron hóa trị của các nguyên tố kim loại chuyển tiếp dãy thứ nhất.
|
Nguyên tố |
Số hiệu nguyên tử |
Cấu hình electron |
Số electron hóa trị |
|
Scandium (Sc) |
21 |
|
|
|
Titanium (Ti) |
22 |
|
|
|
Vanadium (V) |
23 |
|
|
|
Chromium (Cr) |
24 |
|
|
|
Manganese (Mn) |
25 |
|
|
|
Iron (Fe) |
26 |
|
|
|
Cobalt (Co) |
27 |
|
|
|
Nickel (Ni) |
28 |
|
|
|
Copper (Cu) |
29 |
|
|
(b) Trong bảng tuần hoàn, các nguyên tố kim loại chuyển tiếp dãy thứ nhất thuộc loại nguyên tố s, p, d hay f?
(c) Nhận xét chung về cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất về:
+ Đặc diểm giống nhau và khác nhau trong cấu hình electron nguyên tử
+ Sự biến đổi số electron trên phân lớp 3d và 4s
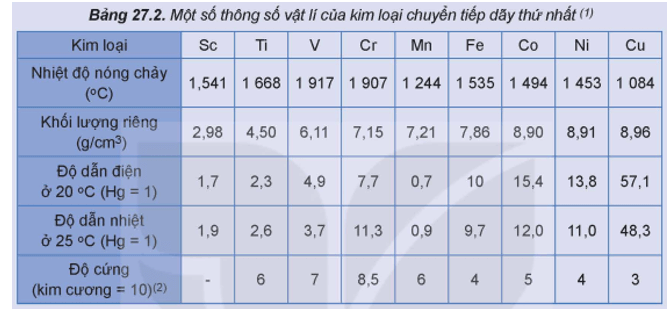
Câu 2. [KNTT - SGK] Một số thông số vật lí của kim loại chuyển tiếp dãy thứ nhất được trình bày ở bảng dưới đây:
(1) Trong số các kim loại chuyển tiếp dãy thứ nhất, hãy chỉ ra:
(a) Các kim loại khó nóng chảy hơn Be. Biết nhiệt độ nóng chảy của Be là 1287oC
(b) Các kim loại nặng (D ≥ 5g/cm3)
(2)
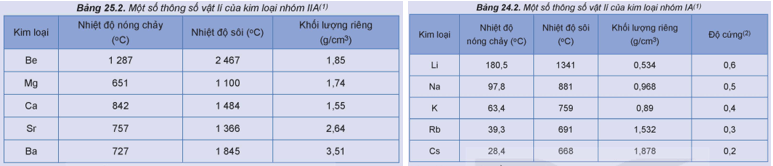
(a) Tra cứu bảng trên và các bảng dưới đây:
Hãy hoàn thành các thông số vật lí của K, Ca, Fe, Cu vào vở theo mẫu bảng sau:
|
Kim loại |
K |
Ca |
Fe |
Cu |
|
Nhiệt độ nóng chảy (oC) |
? |
? |
? |
? |
|
Khối lượng riêng (g/cm3) |
? |
? |
? |
? |
|
Độ dẫn điện ở 20oC (Hg=1) |
13,3 |
28,5 |
? |
? |
|
Độ cứng (kim cương = 10) |
0,4 |
1,75 |
? |
? |
(b) So sánh sự khác biệt về các thông số vật lí trên giữa Fe, Cu ( kim loại chuyển tiếp dãy thứ nhất) với K, Ca (kim loại họ s).
Chủ đề 2: Sơ lược về phức chất
❖HỆ THỐNG LÝ THUYẾT
I. Một số khái niệm cơ bản về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm và các phối tử.
Trong đó: + Nguyên tử trung tâm (thường kí hiệu M) là cation kim loại hoặc nguyên tử kim loại.
+ Phối tử (thường kí hiệu L) là anion hoặc phân tử.
+ Phức chất [MLn] có thể mang điện tích hoặc không mang điện tích.
|
Phức chất |
Điện tích phức chất |
Nguyên tử trung tâm |
Phối tử |
|
[Co(NH3)6]3+ |
+3 |
Cation Co3+ |
Phân tử NH3 |
|
[Zn(OH)4]2- |
-2 |
Cation Zn2+ |
Anion OH- |
|
[Fe(CO)5] |
0 |
Nguyên tử Fe |
Phân tử CO |
- Nếu phức chất [MLn] mang điện thì có thể có thêm cầu ngoại để trung hòa điện tích.
VD: [Cu(NH3)4]2+ hay [Cu(NH3)4](OH)2 đều là phức chất.
II. Liên kết trong phức chất và một số dạng hình học của phức chất
1. Liên kết giữa nguyên tử trung tâm và phối tử
- Liên kết hóa học giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho – nhận, trong đó phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
VD: Trong phức chất [Co(NH3)6]3+ liên kết hóa học được hình thành do phối tử NH3 cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Co3+.
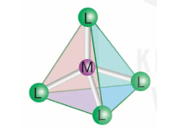
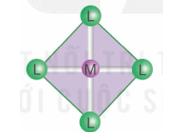
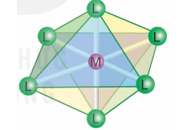
2. Dạng hình học của phức chất
- Trong phức chất, các phối tử sắp xếp một cách xác định xung quanh nguyên tử trung tâm tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
- Dạng hình học của phức chất được xác nhận bằng thực nghiệm.
|
Dạng tứ diện [ML4] |
Dạng vuông phẳng [ML4] |
Dạng bát diện [ML6] |
|
|
|
|
III. Sự hình thành phức chất trong dung dịch
1. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp
- Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của phối tử H2O tạo thành liên kết cho – nhận, hình thành phức chất aqua.
- Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu, chúng thường có dạng hình học bát diện [M(H2O)6]n+: [Cu(H2O)6]2+, [Fe(H2O)6]2+, [Co(H2O)6]3+, …
|
|
|
|
CuSO4 khan màu trắng |
Dung dịch CuSO4 chứa [Cu(H2O)6]2+ màu xanh |
- Theo IUPAC, khi viết công của phức chất nên hướng nguyên tử cho cặp e hóa trị riêng trong phối tử về phía nguyên tử trung tâm nên phức chất [M(H2O)6]n+ có thể viết là [M(OH2)6]n+.
2. Dấu hiệu phản ứng tạo thành phức chất trong dung dịch
- Phản ứng tạo phức chất trong dung dịch có thể được nhận biết dựa vào một số dấu hiệu như: Xuất hiện kết tủa, hòa tan kết tủa, thay đổi màu sắc.
|
Thí nghiệm |
Hiện tượng |
Phức tạo thành |
|
Nhỏ vài giọt dd NaOH vào dd AlCl3 |
Xuất hiện kết tủa |
[Al(OH)3(H2O)3] |
|
Nhỏ vài giọt dd NaCl vào dd AgNO3 sau đó thêm tiếp dung dịch NH3 đến dư. |
Ban đầu xuất hiện kết tủa trắng sau đó kết tủa tan |
[Ag(NH3)2]+ |
|
Nhỏ vài giọt dd HCl đặc vào ống nghiệm chứa dd CuSO4 loãng |
Dung dịch từ màu xanh chuyển sang màu vàng |
[CuCl4]2- |
3. Thí nghiệm sự tạo thành phức chất của ion kim loại chuyển tiếp
♦ Thí nghiệm sự tạo thành phức chất [Cu(NH3)4]2+
- Cho từ từ từng giọt NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4 2% đến khi tạo thành dung dịch trong suốt.
- Hiện tượng: Xuất hiện kết tủa xanh lam sau đó kết tủa tan.
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ xanh lam + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 tan
♦ Thí nghiệm sự tạo thành phức chất [CuCl4]2-
- Thêm 2 mL dung dịch HCl đặc vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4.
- Hiện tượng: Dung dịch từ màu xanh chuyển sang màu vàng.
[Cu(H2O)6]2+ + 4Cl- → [CuCl4]2- + 6H2O
4. Phản ứng thế phối tử của phức chất trong dung dịch
- Quá trình xảy ra sự thế phối tử này bằng phối tử khác được gọi là phản ứng thế phối tử của phức chất. Quá trình này xảy ra thuận lợi khi phức chất mới được hình thành bền hơn phức chất ban đầu.
[Cr(H2O)6]3+(aq) + 6OH-(aq) → [Cr(OH)6]3-(aq) + 6H2O(l) (thế H2O bằng OH-)
[Cu(H2O)6]2+(aq) + 4Cl-(aq) → [CuCl4]2-(aq) + 6H2O(l) (thế H2O bằng Cl-)
[Fe(H2O)6]2+(aq) + 6CN-(aq) → [Fe(CN)6]4- + 6H2O(l) (thế H2O bằng CN-)
[PtCl4]2-(aq) + NH3(aq) → [PtCl3(NH3)]-(aq) + Cl-(aq) (thế 1Cl- bằng 1NH3)
IV. Ứng dụng của phức chất
|
Trong y học |
Trong CN hóa chất |
Trong hóa học |
|
- Chữa trị hoặc kiểm soát bệnh. VD: Phức chất cisplatin [Pt(NH3)2Cl2] dùng làm thuốc chữa bệnh ung thư. |
- Làm chất xúc tác trong điều chế các hợp chất hóa học. VD: Phức chất [Pd(P(C6H5)3)4] xúc tác cho phản ứng ghép mạch carbon. |
- Nhận biết và xác định hàm lượng các ion kim loại chuyển tiếp trong dung dịch. VD: Phức chất [Ag(NH3)2]+ để phân biệt aldehyde và ketone. |
❖ BÀI TẬP TỰ LUẬN
Câu 1. [KNTT - SGK] Cho các phức chất sau: [Cu(H2O)6]2+, [CoF6]3-, [Ni(CO)4], [PtCl2(NH3)2]
(a) Hãy chỉ ra phối tử và nguyên tử trung tâm trong mỗi phức chất trên.
(b) Hãy cho biết số lượng phối tử có trong mỗi phức chất trên.
(c) Hãy cho biết điện tích của mỗi phức chất trên.
Câu 2. [CD - SBT] Nối những đặc điểm ở cột B với phức chất tương ứng ở cột A.
Biết rằng khi ion Cr3+ hoặc nguyên tử Cr tạo phức chất thì trở thành nguyên tử trung tâm chromium có 6 liên kết cho - nhận với các phối tử xung quanh.
|
Cột A |
Cột B |
|
(1) [Cr(en)3]3+ (2) [Cr(NH3)6]6+ (3) [Cr(CO)6] |
(a) Một phối tử chỉ tạo một liên kết cho - nhận với nguyên tử trung tâm (b) Một phối tử tạo hai liên kết cho - nhận với nguyên tử trung tâm (c) Là phức chất trung hoà (d) Là phức chất ion (e) Nguyên tử trung tâm được hình thành từ quá trình cation kim loại nhận các cặp electron hoá trị (g) Nguyên tử trung tâm được hình thành từ quá trình nguyên tử kim loại nhận các cặp electron hoá trị |
Câu 3. [CD - SBT]
(a) Vì sao AgCl không phải là phức chất trong khi cation [H3N–Ag–NH3]+ là phức chất?
(b) Vì sao sodium chloride (NaCl) không phải là một phức chất?
Câu 4. [KNTT - SGK] Cho các phức chất [Ag(NH3)2]+ và [CoF6]3-
Hãy chỉ ra nguyên tử trung tâm, phối tử và giải thích sự hình thành liên kết trong mỗi phức chất trên.
Câu 5. [CD - SGK] Khi cho copper(II) sulfate vào nước thì hình thành phức chất bát diện với các phối tử là 6 phân tử H₂O.
(a) Viết công thức của phức chất.
(b) Vẽ dạng hình học của phức chất trên.
Câu 6. [CTST - SGK] Viết công thức hóa học của phức chất aqua của ion Mn2+ và ion Co3+. Biết chúng đều có hình dạng bát diện.
Câu 7. [KNTT - SGK] Phức chất aqua của Ni2+ và Zn2+ đều có dạng hình học bát diện.
(a) Viết công thức hóa học mỗi phức chất aqua trên.
(b) Mô tả sự hình thành liên kết giữa phối tử và nguyên tử trung tâm trong mỗi phức chất.
Câu 8. [KNTT- SGK] CuSO4 khan màu trắng, khi hòa tan trong nước, các phân tử nước liên kết với ion Cu2+ tạo phức chất aqua [Cu(H2O)6]2+. Hãy cho biết dấu hiệu nào chứng tỏ phức chất aqua đã tạo thành.
Câu 9. [CD - SBT] Dự đoán hiện tượng của quá trình diễn ra khi cho mỗi chất: Ba(OH)2, Na2CO3, NH3, CuO vào dung dịch sulfuric acid loãng dư. Quá trình nào có dấu hiệu của phản ứng tạo phức chất trong dung dịch? Giải thích.
Câu 10. [KNTT - SGK]
(a) Trong dung dịch, ion Co2+ tạo thành phức chất aqua có dạng hình học bát diện. Hãy viết công thức hóa học của phức chất.
(b) Khi cho một lượng dư NH3 vào dung dịch muối CoCl2, thấy màu sắc của dung dịch bị thay đổi. Hiện tượng xảy ra là do toàn bộ các phối tử H2O trong phức chất qua đã bị thay thế bởi các phối tử NH3, tạo thành phức chất mới có dạng bát diện. Viết phương trình hóa học của phản ứng thế phối tử đã xảy ra.
Câu 11. [KNTT - SGK]. Có 3 lọ hóa chất, mỗi lọ đựng dung dịch của một trong các phức chất sau:
[Ag(NH3)2]+, [Cu(H2O)6]2+, [Cu(NH3)4(H2O)2]2+. Hãy nhận biết phức chất có trong mỗi lọ dựa vào màu sắc đặc trưng của chúng.
Câu 12. [CD - SGK] Phản ứng nào dưới đây là phản ứng thay thế phối tử trong phức chất?
(a)
(b)
(c)
Chủ đề 3: Ôn tập chương 8
❖ HỆ THỐNG LÝ THUYẾT
1. Đại cương về kim loại chuyển tiếp dãy thứ nhất
- Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố thuộc chu kì 4, từ Sc (Z = 21) đến Cu (Z = 29).
- Cấu hình electron của nguyên tử các kim loại chuyển tiếp có dạng 3da4sb (a = 1 – 10, b = 1 – 2).
- Kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy cao, thường có độ cứng lớn, khá nặng, dẫn điện và dẫn nhiệt tốt, có nhiều ứng dụng trong thực tiễn.
- Các nguyên tố chuyển tiếp có xu hướng thể hiện nhiều trạng thái oxi hóa. Các ion kim loại chuyển tiếp thường có màu sắc phong phú.
- Sự có mặt của ion Cu2+ hoặc ion Fe3+ trong dung dịch được nhận biết bằng phản ứng tạo thành kết tủa xanh nhạt của Cu(OH)2 hoặc nâu đỏ của Fe(OH)3.
2. Sơ lược về phức chất
- Phức chất là hợp chất chứa nguyên tử trung tâm và các phối tử.
- Trong phức chất, phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tố trung tâm tạo thành liên kết cho – nhận.
- Phức chất có dạng hình học phổ biến là tứ diện, vuông phẳng và bát diện.
- Sự tạo thành phức chất trong dung dịch có thể được nhận ra nhờ các dấu hiệu xuất hiện kết tủa, hòa tan kết tủa hoặc thay đổi màu sắc.
- Trong dung dịch, các ion kim loại chuyển tiếp đều tạo phức chất aqua có dạng [M(H2O)6]n+, hầu hết đều có dạng hình học bát diện.
- Các phối tử trong phức chất có thể bị thay thế một phần hoặc hoàn toàn bởi các phối tử khác.
- Phức chất có ứng dụng trong y học, công nghiệp hóa chất.
❖ BÀI TẬP TỰ LUẬN
Câu 1. [CTST - SBT] Hãy ghép thông tin ở Cột A với thông tin ở Cột B sao cho hợp lí nhất.
|
Cột A |
Cột B |
|
(1) Chromium có độ cứng cao |
(a) Đồng |
|
(2) Độ dẫn điện, dẫn nhiệt cao nhất |
(b) Mạ lên các thiết bị để chống mài mòn |
|
(3) Nhiệt độ nóng chảy cao nhất |
(c) Vanadium |
|
(4) Cobalt |
(d) Dùng làm xúc tác trong phản ứng cộng H2 vào alkene |
|
(5) Nickel |
(e) Chế tạo nam châm điện |
Câu 2. [KNTT - SGK] Hãy chỉ ra phối tử và nguyên tử trung tâm trong phức chất [Zn(OH)4]2- và [PtCl2(NH3)2].
Câu 3. [KNTT - SGK] Xét phản ứng sau: [PtCl4]2- + 2NH3 → [PtCl2(NH3)2] + 2Cl-
Hãy cho biết trong phản ứng trên có bao nhiêu phối tử Cl- trong phức chất [PtCl4]2- đã bị thế bởi phối tử NH3.
Câu 4. [KNTT - SGK] Hãy cho biết dạng hình học có thể có của phức chất có công thức tổng quát [ML4] (bỏ qua điện tích của phức chất).
Câu 5. [KNTT - SGK] Nhỏ từ từ dung dịch NH3 vào AgCl thu được phức chất [Ag(NH3)2]+. Hãy cho biết dấu hiệu chứng tỏ phản ứng tạo phức chất [Ag(NH3)2]+ xảy ra.
Câu 6. [CTST - SBT] Lấy 5 ví dụ phức chất aqua của 5 nguyên tố kim loại chuyển tiếp dãy thứ nhất. Biểu diễn dạng hình học của phức chất trong các ví dụ.
Sử dụng thông tin sau để trả lời các câu hỏi ngắn câu 7 và câu 8. Kết quả được làm tròn đến hai chữ số thập phân với câu 18.
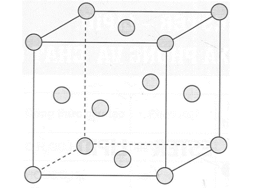
Các đơn chất kim loại Cu, Ag, Au đều có cấu trúc mạng tinh thể lập phương tâm diện với chiều dài cạnh lần lượt là 3,61 Å; 4,08 Å và 4,09 Å. Mỗi quả cầu trong mô hình mạng tinh thể lập phương tâm diện ở hình dưới biểu thị một nguyên tử kim loại.
Câu 7. [CTST - SBT]* Một hình lập phương (ô mạng tinh thể) có thể chứa mấy quả cầu?
Câu 8. [CTST - SBT]* Khối lượng riêng của đơn chất kim loại được tính theo công thức:
Trong đó:
- n là số nguyên tử kim loại trong ô mạng tinh thể;
- M là nguyên tử khối;
- NA là số Avogadro, bằng 6,022.1023;
- V là thể tích của ô mạng.
Cho biết nguyên tử khối của Cu; Ag; Au lần lượt là 63,54 amu; 107,87 amu; 196,97 amu.
Khối lượng riêng của các kim loại đã cho lần lượt bằng bao nhiêu?
Câu 9. [CTST - SBT] Cryolite được dùng làm chất giảm nhiệt độ nóng chảy của Al2O3 khi sản xuất nhôm bằng phương pháp điện phân. Trong tự nhiên, cryolite là một khoáng chất không phổ biến với sự phân bố rất hạn chế, nên để phục vụ cho mục đích trên người ta đã tổng hợp nó.
Giả sử phản ứng tổng hợp cryolite với hiệu suất 80% được thực hiện từ quặng nhôm (có chứa 75% Al2O3, còn lại là chất trơ), acid HF và NaOH.
(a) Cryolite thuộc loại phức chất cation hay anion? Biểu diễn dạng hình học của phức chất.
(b) Tính lượng cryolite tối đa có thể thu được khi sử dụng hết 1,7 tấn quặng nhôm.
BÀI TẬP TRẮC NGHIỆM
1. Trắc nghiệm nhiều lựa chọn
♦ Mức độ BIẾT
Câu 1. Kim loại nào sau đây không thuộc dãy kim loại chuyển tiếp thứ nhất?
A. Sc.
B. Mg
C. Cr
D. Cu
Câu 2. Nguyên tử chromium có số oxi hóa +6 trong hợp chất nào sau đây?
A. KCrO2.
B. Cr2O3.
C. CrO
D. K2CrO4.
Câu 3. Kim loại chuyển tiếp dãy thứ nhất nào sau đây có độ cứng lớn nhất?
A. Fe.
B. Cr.
C. V.
D. Co.
Câu 4. [KNTT - SGK] Cấu hình electron của Fe2+ là
A. 1s22s22p63s23p63d64s2.
B. 1s22s22p63s23p63d6.
C. 1s22s22p63s23p64s23d6.
D. 1s22s22p63s23p63d44s2.
Câu 5. [KNTT - SBT] Cấu hình electron của Cu2+ là
A. [Ar]3d94s2.
B. [Ar]3d104s1.
C. [Ar]3d84s1.
D. [Ar]3d9.
Câu 6. Kim loại được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ (dùng làm thìa, dao, dụng cụ y tế, …) là
A. Cr.
B. Ba.
C. K.
D. Na.
Câu 7. Trong dung dịch muối sulfate, ion kim loại nào sau đây có màu xanh?
A. Mg2+.
B. Fe3+.
C. Cu2+.
D. Mn2+.
Câu 8. [CTST - SBT] Theo chiều tăng dần của điện tích hạt nhân, khối lượng riêng của các kim loại chuyển tiếp dãy thứ nhất
A. giảm dần.
B. tăng dần.
C. tăng đến Cr sau đó giảm
D. giảm đến Fe sau đó tăng.
Câu 9. Nguyên tử trung tâm của các phức chất [PtCl4]2- và [Fe(CO)5] lần lượt là
A. Pt4+ và Fe2+.
B. Pt2+ và Fe2+.
C. Cl và CO.
D. Pt2+ và Fe.
Câu 10. Số lượng phối tử có trong mỗi phức chất [PtCl4]2- và [Fe(CO)5] là
A. 4 và 5.
B. 5 và 6.
C. 5 và 2.
D. 1 và 2.
Câu 11. Trong phức [Zn(NH3)4]2+ số phối tử là
A. 2.
B. 3.
C. 4.
D. 3 hoặc 4.
Câu 12. [KNTT - SBT] Số lượng phối tử trong phức chất [PtCl4(NH3)2] là
A. 6
B. 2
C. 4
D. 7.
Câu 13. [KNTT - SBT] Phức chất của Cr (0) có dạng hình học bát diện chỉ chứa phối tử CO có công thức hóa học là
A. [Cr(CO)4]
B. [Cr(CO)6]
C. [Cr(CO)4]2+
D. [Cr(CO)6]2+
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 12 các chương hay khác:
- Chuyên đề Ester - lipid
- Chuyên đề Carbohydrate
- Chuyên đề Hợp chất chứa Nitrogen
- Chuyên đề Polymer
- Chuyên đề Pin điện và điện phân
- Chuyên đề Đại cương về kim loại
- Chuyên đề Nguyên tố nhóm IA và nhóm IIA
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

