Chuyên đề Nguyên tố nhóm IA và nhóm IIA lớp 12
Tài liệu chuyên đề Nguyên tố nhóm IA và nhóm IIA Hóa học lớp 12 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 12.
Chuyên đề Nguyên tố nhóm IA và nhóm IIA lớp 12
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Chỉ từ 300k mua trọn bộ Chuyên đề dạy thêm Hóa học 12 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chủ đề 1: Nguyên tố nhóm IA
A. KIẾN THỨC TRỌNG TÂM
I. Đơn chất nhóm IA
1. Vị trí và cấu tạo
- Nhóm IA được gọi là nhóm kim loại kiềm, bao gồm các kim loại: Li, Na, K, Rb, Cs, Fr (phóng xạ).
- Cấu hình electron lớp ngoài cùng là ns1.
- Thế điện cực chuẩn rất nhỏ.
- Trong hợp chất, các kim loại nhóm IA chỉ có số oxi hóa +1.
- Các kim loại kiềm đều có cấu trúc mạng tinh thể lập phương tâm khối (kém đặc khít).
2. Trạng thái tự nhiên
- Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất.
VD: Na thường gặp dạng NaCl (trong nước biển, mỏ muối, quặng halite).
K thường gặp dạng khoáng vật sylvinite (NaCl.KCl), carnallite (KCl.MgCl2.6H2O).
3. Tính chất vật lí
- Nhiệt độ nóng chảy và nhiệt độ sôi: Các kim loại nhóm IA có nhiệt độ nóng chảy, nhiệt độ sôi thấp và có xu hướng giảm dần từ Li đến Cs.
- Khối lượng riêng: Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít. Li là kim loại nhẹ nhất trong tất cả các kim loại.
- Độ cứng: Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thấp, có thể cắt bằng dao, kéo. Cs là kim loại mềm nhất trong tất cả các kim loại.
4. Tính chất hóa học
- Do kim loại kiềm có điện cực chuẩn rất nhỏ nên chúng có tính khử mạnh và tính khử tăng dần từ Li đến Cs. M → M+ + 1e
(a) Tác dụng với oxygen
Thí nghiệm: Kim loại kiềm tác dụng với oxygen
- Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
- Hiện tượng: Các kim loại bốc cháy mức độ tăng dần từ Li đến K.
- Các kim loại kiềm tác dụng với oxygen trong không khí theo mức độ tăng dần từ Li đến K và cho màu sắc các ngọn lửa khác nhau.
+ Li cháy cho ngọn lửa màu đỏ tía: 4Li + O2 2Li2O
+ Na cháy cho ngọn lửa màu vàng: 4Na + O2 2Na2O
+ K cháy cho ngọn lửa màu tím nhạt: 4K + O2 2K2O
(b) Tác dụng với chlorine
Thí nghiệm: Kim loại kiềm tác dụng với khí chlorine
- Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
- Hiện tượng: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
- Các kim loại kiềm tác dụng với khí chlorine theo mức độ tăng dần từ Li đến K tạo muối chloride.
2Li + Cl2 2LiCl
2Na + Cl2 → 2NaCl
2K + Cl2 2KCl
(c) Tác dụng với nước
Thí nghiệm: Kim loại kiềm tác dụng với nước.
- Cho mỗi mẩu kim loại Li, Na, K vào một chậu thủy tinh chứa nước. Sau khi kim loại tan hết thêm phenolphthalein vào chậu.
- Hiện tượng: Li: mẩu kim loại chuyển động chậm trên mặt nước.
Na: mẩu kim loại trở thành khối cầu, chạy nhanh trên mặt nước.
K: mẩu kim loại cháy kèm theo tiếng nổ nhẹ.
Kim loại sau khi tan hết thêm phenolphthalein vào chậu thấy dung dịch chuyển sang màu hồng.
- Các kim loại kiềm tác dụng mạnh với nước tạo thành dung dịch kiềm và giải phóng H2.
2Na + 2H2O → 2NaOH + H2↑
2K + 2H2O → 2KOH + H2↑
Do kim loại nhóm IA dễ tác dụng với nước và oxygen trong không khí nên trong phòng thí nghiệm Na, K thường được bảo quản trong dầu hỏa; Li, Rb, Cs thường bảo quản trong ống thủy tinh kín hoặc bình khí hiếm.
II. Hợp chất của kim loại nhóm IA
1. Tính tan
- Hầu hết hợp chất của các kim loại kiềm tan tốt trong nước và phân li thành ion.
2. Nhận biết Li+, Na+, K+
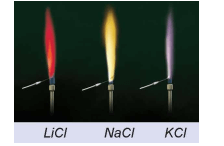
v Thí nghiệm phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa
- Nhúng dây platinium vào ống nghiệm chứa dung dịch LiCl bão hòa, hơ nóng đầu dây trên ngọn lửa đèn khí.
- Tiến hành tương tự với dung dịch NaCl bão hòa và dung dịch KCl bão hòa.
- Hiện tượng: Muối LiCl cháy cho ngọn lửa màu đỏ tía, NaCl cháy cho ngọn lửa màu vàng, KCl cháy cho ngọn lửa màu tím nhạt.
- Có thể phân biệt các hợp chất của kim loại kiềm bằng màu ngọn lửa khi đốt chúng.
3. Hợp chất kim loại kiềm
(a) Sodium chlorine
+ Ứng dụng
+ Điện phân dung dịch NaCl
- Trong công nghiệp chlorine – kiềm, công đoạn chính là điện phân dung dịch NaCl bão hòa, có màng ngăn xốp: 2NaCl + 2H2O 2NaOH + H2 + Cl2
- Màng ngăn xốp ngăn cản không cho Cl2 tạo thành tác dụng với NaOH, nếu không có màng ngăn xốp thì sản phẩm thu được là nước Javel (NaCl, NaClO).
- Các sản phẩm của công nghiệp chlorine – kiềm có nhiều ứng dụng.
+ NaOH: Dùng trong chế biến dầu mỏ, sản xuất nhôm, giấy, xà phòng, …
+ Cl2: Dùng để sản xuất chất tẩy trắng và sát trùng, sản xuất HCl, KClO3, …
+ H2: Dùng để sản xuất HCl, NH3, …
(b) Sodium hydrogencarbonate và sodium carbonate
Ứng dụng
|
Sodium hydrogencarbonate (NaHCO3) |
Sodium carbonate (Na2CO3) |
|
- NaHCO3 còn được gọi là baking soda. - Dễ bị phân hủy khi đun nóng nên được dùng làm bột nở trong chế biến thực phẩm và chất chữa cháy dạng bột: 2NaHCO3 Na2CO3 + CO2 + H2O - Có tính lưỡng tính, tác dụng được với cả dung dịch acid và dung dịch kiềm: NaHCO3 + NaOH Na2CO3 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O - Vì tác dụng được với acid nên trong y học NaHCO3 dùng để chữa chứng đau dạ dày do dư thừa acid. |
- Na2CO3 còn được gọi là soda. - Soda dùng để tẩy rửa vết dầu, mỡ bám trên các dụng cụ, thiết bị do chất béo trong dầu mỡ bị thủy phân trong môi trường kiềm của dung dịch soda. - Soda được sử dụng làm mềm nước cứng, sản xuất thủy tinh, giấy, xà phòng, bột giặt, … |
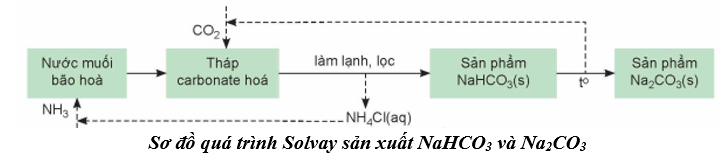
Phương pháp Solvay sản xuất NaHCO3 và Na2CO3
- Nguyên liệu: Đá vôi, muối ăn, ammonium và nước.
- Quá trình sản xuất trải qua hai giai đoạn chính:
+ GĐ1: Tạo NaHCO3 NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl
+ GĐ2: Tạo Na2CO3 2NaHCO3 Na2CO3 + CO2 + H2O
❖ BÀI TẬP TỰ LUẬN
Câu 1. [CD - SGK] Các kim loại kiềm khác nhau về những đặc điểm nào sau đây?
(1) Cấu hình electron của nguyên tử.
(2) Số electron hóa trị của nguyên tử.
(3) Số oxi hóa trong các hợp chất.
(4) Mức độ thể hiện tính khử.
Câu 2. Viết phương trình hóa học của phản ứng giữa Na, K lần lượt với H2O, Cl2, Br2 và O2 (tạo Na2O và K2O).
Câu 3. Hoàn thành chuỗi phản ứng sau:
Câu 4. [CTST - SGK] Viết phương trình hoá học của phản ứng xảy ra trong các thí nghiệm sau:
(a) Cho một mẩu kim loại sodium vào cốc nước.
(b) Sục khí CO2 từ từ đến dư vào dung dịch KOH.
(c) Nhỏ dung dịch HCl từ từ đến dư vào ống nghiệm có chứa sẵn Na2CO3.
(d) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn KHCO3.
(e) Cho một lượng NaHCO3, rắn vào ống nghiệm rồi đun nóng trên ngọn lửa đèn cồn.
Câu 5. [CD - SBT] Viết phương trình hóa học của phản ứng xảy ra khi thực hiện phản ứng giữa sodium lần lượt với lượng dư chlorine, oxygen và lưu huỳnh. Giả sử sodium bị oxi hóa hết trong mỗi phản ứng. Cho một lượng nước thích hợp vào mỗi sản phẩm thu được ở trên để thu được các dung dịch có nồng độ khoảng 0,1 M. Dự đoán pH của mỗi dung dịch thu được và giải thích.
Chủ đề 2: Nguyên tố nhóm IIA
KIẾN THỨC CẦN NHỚ
I. Đơn chất nhóm IIA
1. Vị trí và cấu tạo
- Nhóm IIA được gọi là nhóm kim loại kiềm thổ, bao gồm: Be, Mg, Ca, Sr, Ba, Ra (phóng xạ).
- Cấu hình electron lớp ngoài cùng là ns2.
- Trong hợp chất, các kim loại nhóm IIA có số oxi hóa +2.
2. Trạng thái tự nhiên
- Trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất.
VD: Mg có trong quặng dolomite (CaCO3.MgCO3).
Ca có trong đá vôi, quặng calcite (CaCO3), thạch cao (CaSO4), …
3. Tính chất vật lí
- Bán kính nguyên tử các nguyên tố nhóm IIA tăng dần từ Be đến Ba do số lớp electron tăng dần.
- Các kim loại nhóm IIA là kim loại nhẹ, có nhiệt độ nóng chảy, khối lượng riêng cao hơn kim loại nhóm IA cùng chu kì nhưng tương đối thấp so với các kim loại khác.
4. Tính chất hóa học
- Kim loại nhóm IIA có tính khử mạnh, chỉ kém kim loại nhóm IA.
- Tính khử tăng dần từ Be đến Ba do bán kính nguyên tử tăng, khả năng nhường e tăng.
M → M2+ + 2e
(a) Tác dụng với oxygen
- Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA bốc cháy tạo oxide và cho ngọn lửa có màu đặc trưng. TQ: 2M + O2 2MO
+ Ca cháy cho ngọn lửa màu đỏ cam.
+ Sr cháy cho ngọn lửa màu đỏ son.
+ Ba cháy cho ngọn lửa màu lục.
Các hợp chất Ca2+, Sr2+, Ba2+ khi đốt cháy cũng cho ngọn lửa có màu sắc tương tự kim loại tương ứng Có thể dùng màu ngọn lửa để nhận biết Ca, Sr, Ba hoặc hợp chất của chúng.
(b) Tác dụng với nước
- Be không tác dụng với nước do có màng oxide bảo vệ bề mặt.
- Mg phản ứng chậm với nước ở nhiệt độ thường, nhanh hơn khi đun nóng.
Mg + 2H2O Mg(OH)2 + H2↑
- Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường và mức độ phản ứng tăng dần.
M + 2H2O → M(OH)2 + H2↑ (M là Ca, Sr, Ba)
- Độ tan các hydroxide tăng dần: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2
- Trong phản ứng trên, hydroxide tạo thành càng dễ tan thì càng dễ giải phóng khỏi bề mặt kim loại, tạo điều kiện thuận lợi để kim loại tiếp tục phản ứng với nước.
5. Ứng dụng
- Các kim loại nhóm IIA tạo ra hợp kim có nhiều ứng dụng trong thực tế:
+ Hợp kim của Be có độ bền cơ học, không bị ăn mòn, khó nóng chảy, …
+ Hợp kim của Mg cứng, bền, nhẹ làm vật liệu sản xuất ô tô, máy bay, …
II. Hợp chất của kim loại nhóm IIA
1. Tính tan
Tính tan của các muối carbonate, sulfate và nitrate
- Các muối nitrate đều tan.
- Hầu hết các muối carbonate đều không tan trừ BeCO3 bị thủy phân.
- Các muối BeSO4, MgSO4 tan, SrSO4 và CaSO4 ít tan, BaSO4 không tan.
Bảng tính tan của muối và hydroxide kim loại nhóm IIA
|
Anion |
Cation |
||||
|
Be2+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
|
|
CO32- |
- |
K |
K |
K |
K |
|
SO42- |
T |
T |
I |
I |
K |
|
NO3- |
T |
T |
T |
T |
T |
|
OH- |
K |
K |
I |
T |
T |
T: chất dễ tan, I: chất ít tan, K: chất không tan, -: bị thủy phân
Thí nghiệm so sánh độ tan giữa CaSO4 và BaSO4
- Thêm 2 mL dung dịch CaCl2 vào ống nghiệm (1) và 2 mL dung dịch BaCl2 vào ống nghiệm (2).
- Nhỏ từ từ từn giọt dung dịch CuSO4 vào mỗi ống nghiệm cho đến khi xuất hiện kết tủa.
Nhận xét: Ống nghiệm (2) xuất hiện kết tủa sớm hơn so với ống nghiệm (1) do BaSO4 có độ tan nhỏ hơn CaSO4.
2. Một số hợp chất quan trọng
(a) Muối carbonate
♦ Tác dụng với acid
- Muối carbonate có thể tác dụng với acid → Muối + CO2↑ + H2O
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
- Muối carbonate tan trong nước có hoàn tan khí CO2
CaCO3 + CO2 + H2O → Ca(HCO3)2
♦ Phản ứng nhiệt phân
- Muối carbonate của kim loại nhóm IIA bị nhiệt phân tạo thành oxide và CO2.
TQ: MCO3(s) MO(s) + CO2(g)
- Độ bền nhiệt của các muối có xu hướng tăng từ MgCO3 đến BaCO3, đặc điểm này phù hợp với xu hướng biến đổi giá trị biến thiên enthalpy chuẩn của phản ứng trên.
|
Chất |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
101,08 |
181,31 |
234,55 |
274,68 |
|
|
Nhiệt độ phân hủy (oC) |
350 – 650 |
900 – 1200 |
1100 – 1200 |
1000 – 1450 |
(b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân → Oxide kim loại + NO2 + O2
TQ: M(NO3)2 (s) MO(s) + 2NO2(g) + ½ O2(g)
- Độ bền nhiệt các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2, đặc điểm này phù hợp với xu hướng biến đổi giá trị biến thiên enthalpy chuẩn của phản ứng trên.
|
Chất |
Mg(NO3)2 |
Ca(NO3)2 |
Sr(NO3)2 |
Ba(NO3)2 |
|
255,36 |
369,64 |
452,58 |
510,32 |
|
|
Nhiệt độ phân hủy (oC) |
> 300 |
> 560 |
> 570 |
620 - 670 |
(c) Nhận biết sự có mặt của các ion riêng biệt Ca2+, Ba2+, SO42-, CO32-
|
Ion |
Thuốc thử |
Hiện tượng |
|
Ca2+ |
Dung dịch CO32- |
Kết tủa trắng, tan trong dung dịch acid |
|
Ba2+ |
Dung dịch SO42- |
Kết tủa trắng, không tan trong dung dịch acid |
|
SO42- |
Dung dịch Ba2+ |
Kết tủa trắng, không tan trong dung dịch acid |
|
CO32- |
Dung dịch H+ |
Khí không màu, không mùi |
3. Ứng dụng
|
Nguyên, vật liệu |
Ứng dụng |
|
Đá vôi |
Sản xuất vôi sống, xi măng, vật liệu xây dựng, … |
|
Vôi sống |
Khử chua, sát trùng, tẩy uế, hút ẩm trong công nghiệp, … |
|
Vôi, nước vôi |
Khử chua, làm mềm nước cứng, … |
|
Thạch cao sống: CaSO4.2H2O nung: CaSO4.H2O/ CaSO4.0,5H2O khan: CaSO4 |
Vật liệu xây dựng, phấn viết bảng, đúc tượng, bó bột khi gãy xương … |
|
Apatite Ca3(PO4)2.CaF2 |
Sản xuất phân lân (superphosphate, nung chảy, …), … |
- Một số hợp chất của calcium còn có vai trò quan trọng đối với cơ thể con người như:
+ Ca3(PO4)2, Ca5(PO4)3OH tham gia cấu tạo xương và răng.
+ ion Ca2+ trong cơ thể có chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp (bao gồm cả cơ tim).
III. Nước cứng
1. Khái niệm, phân loại
(a) Khái niệm
- Nước chứa nhiều ion Ca2+ và Mg2+ được gọi là nước cứng.
- Nước chứa ít hoặc không chứa các ion Ca2+ và Mg2+ được gọi là nước mềm.
(b) Phân loại
|
Nước có tính cứng tạm thời |
Nước có tính cứng vĩnh cửu |
Nước có tính cứng toàn phần |
|
Ca2+, Mg2+, HCO3- |
Ca2+, Mg2+, SO42-, Cl- |
Ca2+, Mg2+, HCO3-, SO42-, Cl- |
- Nước trong tự nhiên thường có tính cứng toàn phần.
2. Tác hại của nước cứng
- Đóng cặn nồi hơi đun nước gây tốn nhiên liệu và không an toàn.
- Đóng cặn đường ống dẫn nước làm giảm lưu lượng nước hoặc tắc đường ống.
- Giặt quần áo bằng nước cứng xà phòng tạo ít bọt, tốn xà phòng và tạo muối ít tan bám vào quần áo, làm quần áo mau hỏng.
- Nấu ăn bằng nước cứng làm thực phẩm lâu chín, giảm mùi vị.
3. Làm mềm nước cứng
|
Phương pháp kết tủa |
Phương pháp trao đổi ion |
|
- Nguyên tắc: Chuyển ion Ca2+ và Mg2+ thành dạng kết tủa, thường là CaCO3, MgCO3, Ca3(PO4)2, Mg3(PO4)2. - Đối với nước có tính cứng tạm thời: Đun nóng, dùng Ca(OH)2 vừa đủ hoặc dùng dung dịch chứa CO32- hoặc PO43-. - Đối với nước có tính cứng vĩnh cửu: Dùng ion CO32- hoặc PO43-. |
- Vật liệu trao đổi ion là vật liệu có khả năng trao đổi một số ion trong thành phần cấu tạo của chúng với các ion có trong dung dịch. - Các vật liệu trao đổi ion thường dùng là vật liệu zeolite hoặc nhựa cationite. Khi nước cứng đi qua vật liệu trao đổi ion thì ion Ca2+ và Mg2+ bị giữ lại, ion Na+ hoặc H+ đi vào dung dịch. |
Chủ đề 3: Ôn tập chương 7
A. Lý thuyết cần nhớ
|
ĐƠN CHẤT NHÓM IA |
ĐƠN CHẤT NHÓM IIA |
|
♦ Bao gồm: Li, Na, K, Rb, Cs, Fr*. ♦ Tính chất vật lí - Nhiệt độ nóng chảy thấp, nhiệt độ sôi thấp và có xu hướng giảm dần từ Li đến Cs. - Khối lượng riêng nhỏ và có độ cứng thấp ♦ Tính chất hóa học - Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên thể hiện tính khử mạnh nhất trong các nhóm kim loại. - Mức độ phản ứng tăng dần từ Li đến Cs khi tác dụng với H2O, O2, Cl2. |
♦ Bao gồm: Be, Mg, Ca, Sr, Ba, Ra*. ♦ Tính chất vật lí - Kim loại nhóm IIA đều là kim loại nhẹ, khó nóng chảy hơn kim loại nhóm IA. ♦ Tính chất hóa học - Kim loại nhóm IIA có thế điện cực chuẩn nhỏ nên thể hiện tính khử mạnh (chỉ sau kim loại nhóm IA) và tăng dần từ Be đến Ba. - Ở điều kiện thường, kim loại nhóm IIA dễ bị oxi hóa bởi không khí (trừ Be). Khi đốt nóng trong oxygen, Be cháy chậm, các kim loại khác cháy mạnh. - Ở điều kiện thường, Be không phản ứng với nước, Mg phản ứng chậm, các kim loại khác phản ứng mạnh với nước. |
|
HỢP CHẤT CỦA KIM LOẠI NHÓM IA |
HỢP CHẤT CỦA KIM LOẠI NHÓM IIA |
|
♦ Tính tan và màu ngọn lửa - Tính tan trong nước: hydroxide và đa số các muối đều dễ tan. - Màu ngọn lửa kim loại và ion kim loại: Li+ màu đỏ tía, Na+ màu vàng, K+ màu tím nhạt. ♦ Một số hợp chất quan trọng - NaCl có nhiều ứng dụng trong đời sống, sản xuất, y học. Phản ứng điện phân dung dịch NaCl bão hòa là cơ sở của công nghiệm chlorine – kiềm. - NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay từ các nguyên liệu chính là đá vôi, muối ăn, ammonia và nước. |
♦ Tính tan và màu ngọn lửa - Tính tan trong nước: + Các muối CO32- và SO42- đều ít tan hoặc không tan (trừ MgSO4). + Các muối NO3- đều dễ tan. + Mg(OH)2 không tan, Ca(OH)2 ít tan, Sr(OH)2 và Ba(OH)2 dễ tan. - Màu ngọn lửa kim loại và ion kim loại: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục. ♦ Một số hợp chất quan trọng - Muối CO32- tác dụng được với acid và nước có hòa tan CO2. - Độ bền nhiệt của muối CO32- và NO3- có xu hướng tăng dần từ Be đến Ba. ♦ Nước cứng - Nước cứng là nước có chứa nhiều ion Ca2+ và Mg2+. - Làm mềm nước cứng bằng phương pháp kết tủa hoặc phương pahps trao đổi ion. |
❖ BÀI TẬP TỰ LUẬN
Câu 1. Hoàn thành chuỗi phản ứng sau:
Câu 2. Hoàn thành chuỗi phản ứng sau:
Câu 3. [KNTT - SGK] Trong công nghiệp, quá trình nung vôi được thực hiện theo phản ứng:
--------------------------- CaCO3(s) → CaO(s) + CO2(g) = 179,2 kJ
(a) Cho biết quá trình nung vôi là quá trình toả nhiệt hay quá trình thu nhiệt.
(b) Trình bày một số ứng dụng chính của sản phẩm nung vôi.
(c) Nêu một số tác hại của quá trình nung vôi thủ công đối với môi trường.
Câu 4. [CTST - SBT] Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm thông qua phản ứng theo phương trình hoá học sau:
NH4HCO3(s) NH3(g) + CO2(g) + H2O(g)
Cho giá trị nhiệt tạo thành của các chất theo bảng sau:
|
Chất |
NH4HCO3(s) |
NH3(g) |
CO2(g) |
H2O(g) |
|
∆fH298o (kJ/mol) |
-849,40 |
-45,90 |
-393,50 |
-241,82 |
Xác định biến thiên enthalpy của phản ứng trên.
BÀI TẬP TRẮC NGHIỆM
1. Trắc nghiệm nhiều lựa chọn
♦ Mức độ BIẾT
Câu 1. [CTST - SBT] Trong các kim loại sau, kim loại nào có tính khử mạnh nhất?
A. K.
B. Al.
C. Mg.
D. Na.
Câu 2. [CTST - SBT] Kim loại không phản ứng với nước ở nhiệt độ thường là
A. Be.
B. Ca.
C. Li.
D. K.
Câu 3. [KNTT - SBT] Trong nhóm IA và IIA, theo chiều từ trên xuống dưới trong mỗi nhóm, tính kim loại biến đổi như thế nào?
A. Không đổi.
B. Giảm dần.
C. Tăng dần.
D. Không có quy luật.
Câu 4. [KNTT - SBT] Kim loại nhóm IA nào sau đây dễ mất electron hoá trị nhất, được dùng sản xuất tế bào quang điện?
A. Cs.
B. Li.
C. Na.
D. K.
Câu 5. [KNTT - SBT] Khi đốt nóng tinh thể NaCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu
A. đỏ cam.
B. tím nhạt.
C. vàng.
D. đỏ tía.
Câu 6. [KNTT - SBT] Ở nhiệt độ phòng, muối nào sau đây dễ tan trong nước?
A. SrSO4.
B. MgSO4.
C. CaSO4.
D. BaSO4.
Câu 7. [KNTT - SBT] Các đại dương là những kho muối vô tận với nhiều khoáng chất có giá trị dinh dưỡng cao. Trong nước biển, hai nguyên tố kim loại có nhiều nhất là
A. sodium và magnesium.
B. đồng và kẽm.
C. nhôm và sắt.
D. vàng và bạc.
Câu 8. [KNTT - SBT] Kim loại Na ở chu kì 3, nhóm IA trong bảng tuần hoàn, cấu hình electron lớp ngoài cùng của nguyên tử Na ở trạng thái cơ bản là
A. 3s23p5.
B. 3s2.
C. 3s1.
D. 3s23p1.
Câu 9. [KNTT - SBT] Các hợp chất dễ tan của kim loại kiềm, kiềm thổ là thành phần cung cấp dinh dưỡng của nhiều loại phân bón hoá học phổ biến. Hợp chất nào sau đây dễ tan, là thành phần dinh dưỡng chính trong phân bón superphosphate?;
A. KCl.
B. CaSO4.2H2O.
C. NaNO3.
D. Ca(H2PO4)2.
Câu 10. [KNTT - SBT] Nước chứa nhiều các ion nào sau đây có tính cứng toàn phần?
A. Mg2+, Ca2+, HCO3-, SO42-.
B. Na+, K+, SO42-, Cl-.
C. Mg2+, Ca2+, HCO3-.
D. Mg2+, Ca2+, SO42-, Cl-.
Câu 11. [CTST - SBT] Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của
A. ion Ca2+, Mg2+.
B. ion HCO3-.
C. ion Cl-, SO42-.
D. ion Ca2+.
Câu 12. [KNTT - SGK] Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các ion nào sau đây?
A. Ion sulfate và ion chloride.
B. Ion nitrate và ion hydrogencarbonate.
C. Ion magnesium và ion calcium.
D. Ion sodium và ion potassium.
Câu 13. [KNTT - SBT] Phân tích một mẫu nước tự nhiên thấy chứa nhiều các ion: Na+, Ca2+, HCO3-, Cl- và SO42-. Chất nào sau đây có thể làm mềm mẫu nước trên?
A. Na2CO3.
B. Ca(OH)2.
C. NaOH.
D. HC1.
Câu 14. [KNTT - SBT] Một loại nước cứng khi đun sôi thì trở thành nước mềm. Trong loại nước này có hoà tan những hợp chất nào sau đây?
A. Ca(HCO3)2 và Mg(HCO3)2.
B. Ca(HCO3)2 và MgSO4.
C. CaSO4 và MgCl2.
D. MgCl2 và CaCl2.
♦ Mức độ HIỂU
Câu 15. [KNTT - SBT] Trong các kim loại nhóm IA từ Li đến Cs, nhiệt độ nóng chảy và độ cứng biến đổi như thế nào?
A. Không đổi.
B. Giảm dần.
C. Tăng dần.
D. Không có quy luật.
Câu 16. [KNTT - SGK] Khi so sánh kim loại nhóm IA với các kim loại khác trong cùng chu kì, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất.
B. Có thế điện cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất.
D. Có nhiều electron hoá trị nhất.
Câu 17. [KNTT - SBT] Trong quá trình Solvay, NH3 được tái chế khi cho dung dịch NH4C1 tác dụng với
A. CaO.
B. NaOH.
C. KOH.
D. Ba(OH)2.
Câu 18. Chất nào sau đây không bị phân huỷ khi đun nóng?
A. Mg(NO3)2.
B. CaCO3.
C. NaCl.
D. Mg(OH)2.
Câu 19. [CTST - SBT] Cách nào sau đây không thu được NaOH sau phản ứng?
A. Điện phân dung dịch NaCl không có màng ngăn xốp.
B. Cho kim loại Na tác dụng với nước.
C. Điện phân dung dịch NaCl có màng ngăn xốp, điện cực trơ.
D. Cho dung dịch Ca(OH)2 tác dụng với dung dịch Na2CO3.
Câu 20. [KNTT - SBT] Xét phản ứng phân huỷ muối carbonate của kim loại nhóm IIA:
MCO3(s) MO(s) + CO2(g)
Từ MgCO3 đến BaCO3, biến thiên enthalpy chuẩn của phản ứng biến đổi như thế nào?
A. Không đổi.
B. Giảm dần.
C. Tăng dần.
D. Không có quy luật.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 12 các chương hay khác:
- Chuyên đề Ester - lipid
- Chuyên đề Carbohydrate
- Chuyên đề Hợp chất chứa Nitrogen
- Chuyên đề Polymer
- Chuyên đề Pin điện và điện phân
- Chuyên đề Đại cương về kim loại
- Chuyên đề Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




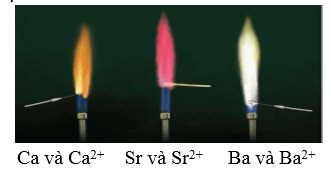




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

