K (Potassium) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
Bài viết về tính chất hóa học của K (Potassium) gồm đầy đủ thông tin cơ bản về K trong bảng tuần hoàn, tính chất hóa học, tính chất vật lí, cách điều chế và ứng dụng.
K (Potassium) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
I. Định nghĩa K (Potassium)
- Potassium là một kim loại kiềm được phát hiện bởi Sir Humphry Davy năm 1807, ông tách nó ra từ dung dịch KOH. Kim loại kiềm này là kim loại đầu tiên được điều chế bằng điện phân.
- Kí hiệu: K
- Cấu hình electron: [Ar] 4s1
- Số hiệu nguyên tử: 19
- Khối lượng nguyên tử: 39 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 19
+ Nhóm: IA
+ Chu kì: 4
- Đồng vị: 39K, 40K, 41K.
- Độ âm điện: 0,82
II. Tính chất vật lí của K (Potassium) & nhận biết
1. Tính chất vật lí:
- Potassium là kim loại nhẹ thứ hai sau liti, là chất rắn rất mềm, dễ dàng cắt bằng dao và có màu trắng bạc.
- Potassium bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa.
- Có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,510C và sôi ở 7600C.
2. Nhận biết
- Đốt cháy các hợp chất của potassium, cho ngọn lửa màu tím.
III. Tính chất hóa học của K (Potassium)
- Potassium là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
a. Tác dụng với phi kim
b. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
c. Tác dụng với nước
- K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
d. Tác dụng với hidro
- Potassium tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Potassium hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
IV. Trạng thái tự nhiên của K (Potassium)
- Dạng tự nhiên của K có 3 đồng vị: K39 (93,3%), K40(0,01%) và K41 (6,7%).
- Nguyên tố này chiếm khoảng 2,4% trọng lượng lớp vỏ Trái Đất và là nguyên tố phổ biến thứ bảy trong lớp này. Vì tính không hòa tan của nó, rất khó thu được Potassium từ các khoáng chất của nó.
V. Điều chế K (Potassium)
- Potassium có thể điều chế nhờ điện phân nóng chảy potassium chloride
VI. Ứng dụng của K (Potassium)
- Các loại phân hóa học chứa Potassium như clorua potassium, sulfat potassium, carbonate Potassium v.v ………
+ nitrate Potassium được sử dụng trong thuốc súng.
+ carbonate Potassium được sử dụng trong sản xuất thủy tinh.
+ Thủy tinh được xử lý bằng Potassium lỏng là có độ bền cao hơn so với thủy tinh thường.
+ NaK là hợp kim của Potassium với natri được sử dụng như là chất truyền nhiệt trung gian.
+ Nguyên tố này là thành phần rất cần thiết cho sự phát triển của cây cối và được tìm thấy trong nhiều loại đất
VII. Các hợp chất quan trọng của Kali
- potassium hydroxide: KOH
Xem thêm tính chất hóa học của các chất khác:
- Tính chất của Cs (Caesium)
- Tính chất của Be (Beryllium)
- Tính chất của Mg (Magnesium) và hợp chất của Mg
- Tính chất của Ca (Calcium) và hợp chất của Ca
- Tính chất của Ba (Barium) và hợp chất của Ba
- Tính chất của Al (Aluminium) và hợp chất của Al
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Wiki tính chất hóa học trình bày toàn bộ tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

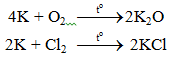
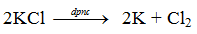



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

