Đề thi vào 10 chuyên Hóa tỉnh Đắk Lắk năm 2022
Đề thi vào 10 chuyên Hóa tỉnh Đắk Lắk năm 2022
Với Đề thi vào lớp 10 chuyên Hóa tỉnh Đắk Lắk năm 2022 chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong kì thi tuyển sinh vào 10 môn Hóa.
Sở Giáo dục và Đào tạo Đắk Lắk
Kì thi tuyển sinh vào 10
Năm 2022
Bài thi môn: Hóa học
Thời gian làm bài: 150 phút
(không kể thời gian phát đề)
⦁ Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Br = 80; Ag = 108
⦁ Các thể thích khí đều đo ở điều kiện tiêu chuẩn.
Câu 1 (1,5 điểm)
1. Viết phương trình hóa học của các phản ứng xảy ra khi:
a) Đốt cháy khí metan.
b) Cho canxi cacbonat vào dung dịch axetic
c) Cho kim loại Na vào rượu etylic 23o.
d) Thổi từ từ khí CO2 đến dư vào dung dịch NaOH
Hướng dẫn giải:
a) CH4 + 2O2 CO2 + 2H2O
b) CaCO3 + 2CH3COOH → (CH3COO)2Ca + CO2↑ + H2O
c) 2C2H5OH + 2Na → 2C2H5ONa + H2
2H2O + 2Na → 2NaOH + H2
d) Ban đầu: CO2 + 2NaOH → Na2CO3 + H2O
Sau đó: CO2 + Na2CO3 + H2O → 2NaHCO3
2. Bằng phương pháp hóa học hãy nhật biết các chất bột có màu tương tự nhau chứa trong các lọ mất nhãn riêng biệt sau : FeO, Fe3O4 và Fe2O3.
Hướng dẫn giải
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng dung dịch HNO3 đặc làm thuốc thử:
+ Chất rắn tan, không có khí thoát ra: Fe2O3
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Chất rắn tan, có khí màu nâu đỏ thoát ra: FeO và Fe3O4 (nhóm I)
FeO + 4HNO3 đặc → Fe(NO3)3 + NO2 + 2H2O
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
- Phân biệt FeO và Fe3O4: Cho lần lượt từng mẫu chất tác dụng hết với HCl, sau đó thêm một ít bột đồng.
+ Nếu bột Cu tan, tạo dung dịch màu xanh → mẫu thử ban đầu là Fe3O4
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
+ Nếu bột Cu không tan → mẫu thử ban đầu là FeO
FeO + 2HCl → FeCl2 + H2O
Cu + FeCl2 → không phản ứng.
Câu 2 (1,5 điểm)
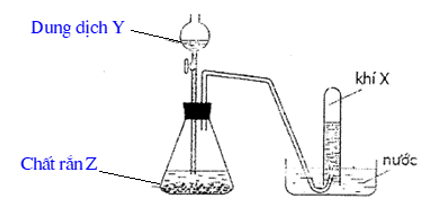
1. Hình vẽ sau đây mô tả thí nghiệm điều chế X từ dung dịch Y và chất rắn Z :
a) Hãy đề xuất 3 chất khí X có thể điều chế bằng thiết bị trên. Viết các phương trình hóa học
b) Có 1 bạn học sinh đề xuất thiết bị trên để điều chế khí HCl từ dung dịch H2SO4 loãng và NaCl rắn. Theo em, ý kiến của bạn đúng hay sai? Vì sao hãy giải thích.
Hướng dẫn giải:
a) 3 chất khí có thể điều chế bằng thiết bị trên là: H2; CO2; O2.
Phương trình hóa học:
+ Khí H2:
Zn (rắn) + H2SO4 (dd) → ZnSO4 + H2↑
+ Khí CO2:
CaCO3 (rắn) + 2HCl (dd) → CaCl2 + CO2↑ + H2O
+ Khí O2:
2H2O2 (dd) 2H2O + O2↑
b) Ý kiến của bạn là sai vì:
+ NaCl rắn không tác dụng với H2SO4 loãng
+ Giả sử có HCl sinh ra cũng không thể thu khí HCl bằng phương pháp đẩy nước như hình vẽ vì HCl tan tốt trong nước.
2. Trong phòng thí nghiệm chỉ có khí CO2, dung dịch NaOH không rõ nồng độ và 2 cốc thủy tinh chia độ. Hãy điều chế dung dịch Na2CO3 không bị lẫn NaOH hoặc NaHCO3 mà không dùng thêm bất cứ một dụng cụ hay hóa chất nào khác. Giả thiết các khí trong không khí không ảnh hưởng đến kết quả thí nghiệm.
Hướng dẫn giải:
- Chia đều lượng thể tích dung dịch NaOH vào 2 cốc thủy tinh chia độ:
+ Cốc 1: NaOH (x mol)
+ Cốc 2: NaOH (x mol)
- Sục khí CO2 đến dư vào cốc 1:
CO2(dư) + NaOH → NaHCO3 (1)
x x mol
- Sau đó đổ NaOH ở cốc 2 vào cốc 1:
NaOH + NaHCO3 → Na2CO3 + H2O (2)
Phản ứng (2) xảy ra vừa đủ nên không còn dư NaOH hoặc NaHCO3.
Câu 3 (2,0 điểm)
1. Trộn 100 ml dung dịch H2SO4 aM với 150 ml dung dịch NaOH 2,0M thu được dung dịch D. Dung dịch D có thể hòa tan được tối đa m gam Al thu được dung dịch E gồm hai chất tan có nồng độ mol bằng nhau. Tính m và a.
Hướng dẫn giải:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,1a 0,03 mol
Trường hợp 1: Dung dịch D chứa Na2SO4 (0,015 mol) và H2SO4 dư (0,1a – 0,015 mol)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
→ Hai chất tan còn lại gồm: Na2SO4 (0,015 mol) và Al2(SO4)3 ( mol)
Nồng độ bằng nhau
Trường hợp 2: Dung dịch D chứa Na2SO4 (0,1 a mol) và NaOH dư (0,03 – 0,2a mol)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Hai chất tan còn lại gồm: Na2SO4: 0,1a mol và NaAlO2: 0,03 – 0,2a mol
Nồng độ bằng nhau →
2. Xác định các chất vô cơ X1, X2, X3, X4, X5, X6, X7và hoàn thành sơ đồ chuyển đổi hóa học dưới đây
X1+ axit X2 (đặc) X3+ X4+ X5+ H2O
X3+ NaOH Na2SO4 + X6
X6 X7+ H2O
X1 + O2 dư X7+ X5
Cho biết:
- X1có khối lượng mol là 116g/mol
- X4, X5là các chất khí ở điều kiện thường, làm đục nước vôi trong; X4làm mất màu nước brom; còn X5thì không:
X4+ Br2 + H2O ⟶ axit X2 + HBr
Hướng dẫn giải:
X4; X5 là các chất khí làm đục nước vôi trong.
X4 làm mất màu nước brom, X5 thì không.
→ X4 là SO2 và X5 là CO2.
Tới đây có thể đoán được X1 là FeCO3
Câu 4 (2,5 điểm)
1. Cho 3 hợp chất hữu cơ X, Y, Z và có công thức phân tử dạng (CH2O)n với n ≤ 3 và MX < MY < MZ.
Cho biết:
- X có phản ứng tráng gương.
- Y vừa phản ứng với kim loại Na, vừa phản ứng tráng gương.
- Z tác dụng với dung dịch NaHCO3. Mặt khác, x mol Z phản ứng với Na dư thu được x mol khí. Ngoài ra, oxi hóa Z trong điều kiện thích hợp tạo ra hợp chất chỉ chứa một loại nhóm chức.
Hãy tìm công thức phân tử và công thức cấu tạo của X, Y, Z.
Hướng dẫn giải:
X, Y, Z có công thức phân tử dạng (CH2O)n với n ≤ 3 và MX < MY < MZ
→ Công thức phân tử:
- X có phản ứng tráng gương → X chứa nhóm chức – CHO và X có 1 nguyên tử O.
→ X có dạng: R – CHO (với X có CTPT: CH2O)
→ Công thức cấu tạo của X: HCHO
- Y vừa phản ứng với kim loại Na, vừa phản ứng tráng gương.
→ Y chứa các nhóm chức:
Do Y có 2 nguyên tử O nên Y có dạng: HO – R – CHO
Lại có Y có CTPT: C2H4O2 nên công thức cấu tạo của Y là HO – CH2 – CHO
- Z tác dụng với dung dịch NaHCO3. Mặt khác, x mol Z phản ứng với Na dư thu được x mol khí → Z có dạng: HO – R1 – COOH
Ngoài ra, oxi hóa Z trong điều kiện thích hợp tạo ra hợp chất chỉ chứa một loại nhóm chức.
Ta có sơ đồ:
HO – R1 – COOH + O2 → HOOC – R2 – COOH + H2O
Vậy Z phải có dạng: HO – CH2 – R2 – COOH
Vậy công thức cấu tạo của Z: HO – CH2 – CH2 - COOH
2. Hỗn hợp Q gồm hai hiđrocacbon mạch hở K, L (là chất khí ở điều kiện thường, MK < ML). Dẫn từ từ 0,672 lít Q qua dung dịch Br2 dư thấy có 8,0 gam brom phản ứng và không có khí thoát ra. Nếu đốt cháy hoàn toàn 0,672 lít Q trên thu được 1,792 lít CO2.
Xác định công thức phân tử của K, L.
Hướng dẫn giải:
● nQ = 0,03mol; nCO2 = 0,08mol; nBr2 = 0,05mol
Gọi công thức phân tử của Q có dạng:
Bảo toàn C và dựa vào số mol Br2 có:
Q chắc chắn có C2H2 ( k = 2) và C2H4 (k = 1)
Trường hợp 1: Q gồm C2H2 (k = 2) và → Hidrocacbon còn lại dạng CaH2a (k = 1)
Đặt
Trường hợp 2: Q gồm C2H4 (k = 1) và → Hidrocacbon còn lại dạng
Đặt
Câu 5 (2,5 điểm)
1. Hỗn hợp T có khối lượng 8,14 gam gồm CuO, Al2O3 và một oxit sắt. Dẫn khí CO dư qua T nung ở nhiệt độ cao, sau khi phản ứng hoàn toàn thấy khối lượng chất rắn giảm 1,28 gam. Hòa tan hoàn toàn T cần dùng 170 ml dung dịch H2SO4 1M, thu được được dung dịch U. Cho U tác dụng với dung dịch NaOH dư, lọc lấy kết tủa đem nung trong không khí đến khối lượng thu được 5,20 gam chất rắn.
Xác định công thức của oxit sắt và tính khối lượng oxit trong hỗn hợp T.
Hướng dẫn giải:
2. Lên men giấm V ml rượu 460 thu được dung dịch A. Chia A thành hai phần bằng nhau :
- Phần 1: Cho tác dụng với Na dư thu được 49,28 lít H2.
- Phần 2: Tác dụng với NaHCO3 dư thu được 13,44 lít CO2.
Biết: Khối lượng riêng của ancol nguyên chất là 0,8g/ml, khối lượng riêng của nước là 1,0 g/ml.
a) Viết các phương trình hóa học. Tính V
b) Tính hiệu suất của phản ứng lên men giấm
Hướng dẫn giải:
Lưu ý: Vì chia làm hai phần bằng nhau nên ta gấp đôi dữ kiện.
Phần 1: Tác dụng với Na
Phần 2: Tác dụng với NaHCO3
Xem thêm các đề thi vào lớp 10 chuyên Hóa chọn lọc, hay khác:
- Đề thi vào 10 chuyên Hóa Tp. Hà Nội năm 2025
- Đề thi vào 10 chuyên Hóa trường THPT Lê Khiết
- Đề thi vào 10 chuyên Hóa Tp. Hà Nội năm 2007 - 2008
- Đề thi vào 10 chuyên Hóa tỉnh Bình Định năm 2025
- Đề thi vào 10 chuyên Hóa tỉnh Tuyên Quang năm 2025
- Đề thi vào 10 chuyên Hóa trường THPT chuyên Khoa học tự nhiên
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)

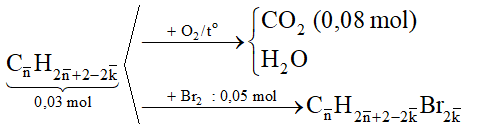
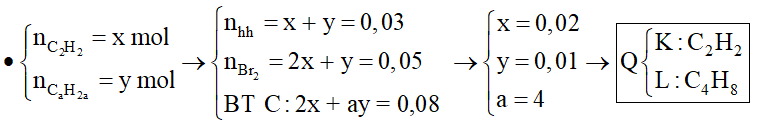
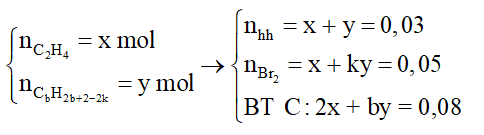
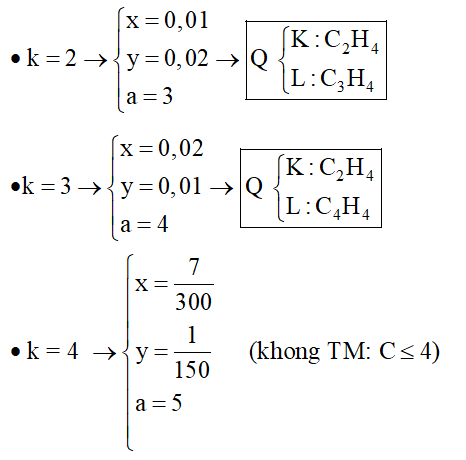
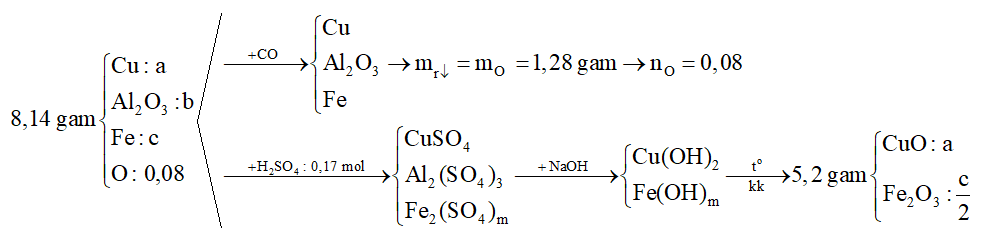
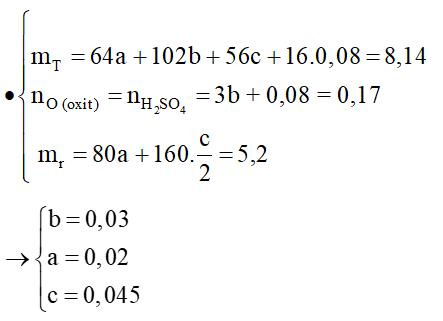
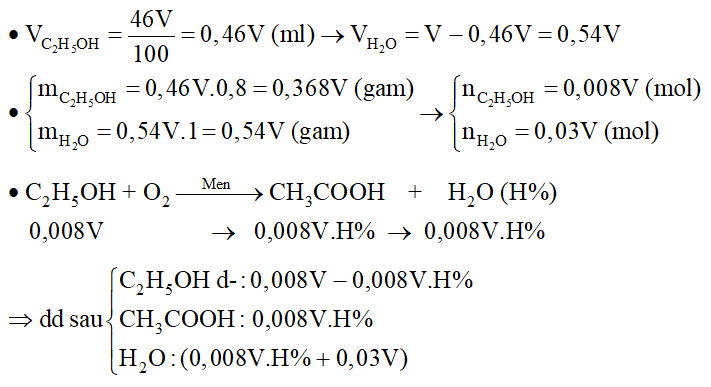
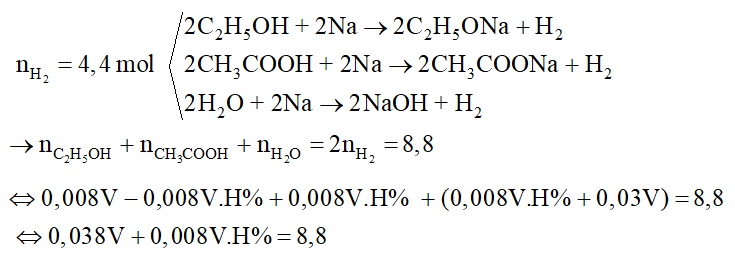



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

