Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 5 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 5: Pin điện và điện phân có đáp án chi tiết đầy đủ các mức độ sẽ giúp học sinh lớp 12 ôn luyện Hóa học 12.
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 5 (có lời giải)
Chỉ từ 200k mua trọn bộ Bài tập ôn tập + Đề kiểm tra Hóa học 12 Chân trời sáng tạo theo chương theo cấu trúc mới bản word có lời giải chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi học sinh chỉ chọn một phương án.
Câu 1. Cặp oxi hóa – khử của kim loại là
A. dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại.
B. dạng oxi hóa và dạng khử của cùng một hợp chất của kim loại.
C. dạng oxi hóa và dạng khử của các dạng thù hình của một nguyên tố kim loại.
D. dạng oxi hóa và dạng khử của một cation kim loại và kim loại đó.
Câu 2. Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng nhỏ thì dạng khử có tính khử …(I)… và dạng oxi hoá có tính oxi hoá …(II)….
Các cụm từ cần điền vào (I) và (II) lần lượt là
A. càng mạnh và càng yếu.
B. càng mạnh và càng mạnh.
C. càng yếu và càng yếu.
D. càng yếu và càng mạnh.
Câu 3. Trong quá trình hoạt động của pin điện hoá Zn-Cu, nhận định nào sau đây không đúng về vai trò của cầu muối?
A. Cho phép các ion di chuyển qua.
B. Cho dòng electron chạy qua.
C. Trung hoà điện ở mỗi dung dịch điện li.
D. Đóng kín mạch điện.
Câu 4. Cặp oxi hoá - khử nào sau đây có giá trị thế điện cực chuẩn lớn hơn 0?
A. K+/K.
B. Li+/Li.
C. Ba2+/Ba.
D. Cu2+/Cu.
Câu 5. Cho thế điện cực chuẩn của các cặp oxi hoá – khử: Fe2+/Fe, Na+/Na, Ag+/Ag, Mg2+/Mg, Cu2+/Cu lần lượt là -0,44V, -2,713V, +0,799V, -2,353V, +0,340V. Ở điều kiện chuẩn, kim loại Cu khử được ion kim loại nào sau đây?
A. Na+.
B. Mg2+.
C. Ag+.
D. Fe2+.
Câu 6. Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là
A. M → Mn+ + ne.
B. Mn+ + ne → M.
C. Mn+ → M + ne.
D. M + ne → Mn+.
Câu 7. Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
Cặp oxi hoá-khử |
Li+/Li |
Mg2+/Mg |
Zn2+/Zn |
Ag+/Ag |
Thế điện cực chuẩn, V |
-3,040 |
-2,356 |
-0,762 |
+0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg.
B. Zn.
C. Ag.
D. Li.
Câu 8. Trong pin điện hoá Zn-Cu, phản ứng hoá học xảy ra giữa hai dạng nào của các cặp oxi hoá-khử tương ứng?
A. Zn và Cu2+.
B. Zn và Cu.
C. Zn2+ và Cu2+.
D. Zn và Cu2+.
Câu 9. Trong quá trình hoạt động của pin điện Zn-Cu, dòng electron di chuyển từ
A. cực kẽm sang cực đồng.
B. cực bên phải sang cực bên trái.
C. cathode sang anode.
D. cực dương sang cực âm.
Câu 10. Trong quá trình hoạt động của pin điện Ni-Cu, quá trình xảy ra ở anode là
A. Ni → Ni2+ + 2e.
B. Cu → Cu2+ + 2e.
C. Cu2+ + 2e → Cu.
D. Ni2+ + 2e → Ni.
Câu 11. Trong quá trình hoạt động của pin điện Cu-Ag, điện cực đồng
A. là điện cực dương.
B. là cathode.
C. là điện cực bị giảm dần khối lượng.
D. là nơi xảy ra quá trình khử.
Câu 12. Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình
A. oxi hóa ion K+.
B. khử ion K+.
C. oxi hóa ion Cl–.
D. khử ion Cl–.
Câu 13. Dung dịch X chứa hỗn hợp các muối: MgCl2, CuCl2, FeCl2 và KCl. Kim loại tách ra đầu tiên ở cathode khi điện phân dung dịch là
A. Cu.
B. Mg.
C. K.
D. Fe.
Câu 14. Sodium được sản xuất trong công nghiệp bằng phương pháp nào?
A. Phương pháp thủy luyện.
B. Phương pháp nhiệt luyện.
C. Phương pháp điện phân.
D. Phương pháp điện phân nóng chảy.
Câu 15. Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ?
A. NaBr.
B. NaCl.
C. CuSO4.
D. CuCl2.
Câu 16. Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình
A. Ag → Ag+ + 1e.
B. Fe → Fe2++ 2e.
C. 2H2O → 4H+ + O2 + 4e.
D. C → C4+ + 4e.
Câu 17. Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
A. khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
B. khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
C. khối lượng cả hai điện cực Zn và Cu đều tăng.
D. khối lượng cả hai điện cực Zn và Cu đều giảm.
Câu 18. Trong công nghiệp, quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) tạo ra khí nào sau đây ở cathode?
A. Hydrogen.
B. Chlorine.
C. Oxygen.
D. Hydrogen chloride.
PHẦN II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Câu 19. Cho phản ứng: Ce4+ + 2I- → I2 + Ce3+.
a) Phản ứng trên đã cân bằng
b) Chất oxi hóa là Ce4+, chất khử là I-.
c) Cặp oxi hóa – khử của kim loại cerium là Ce4+/Ce, của iodine là I2/2I-
d) Phương trình hóa học của phản ứng là 2Ce4+ + 2I- → I2 + 2Ce3+.
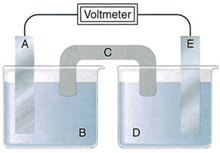
Câu 20. Xét pin Galvani tạo bởi hai điện cực kim loại:
a) A là anode, E là cathode, C là cầu muối.
b) Nếu Alà Zn thì B phải là ZnSO4.
c) Nếu C chứa KNO3 thì ion K+ được chuyển từ C vào D.
d) Chiều dòng điện ở mạch ngoài từ A sang E.
Câu 21. Trong công nghiệp, từ nguồn kim loại thô có thể tinh chế kim loại bằng phương pháp điện phân.
a. Nguyên tắc chung để điều chế kim loại là oxi hóa ion kim loại thành kim loại.
b. Trong sự điện phân ở anode xảy ra sự oxi hóa, ở cathode xảy ra sự khử.
c. Các kim loại mạnh như Na, K, Mg, Ca, K… được sản xuất bằng phương pháp điện phân nóng chảy hợp chất ion của chúng.
d. Trong công nghiệp nhôm được sản xuất bằng cách điện phân aluminium oxide nóng chảy.
Câu 22. Cho pin Galvani Zn-Cu hoạt động với phương trình hóa học sau:
a. Điện cực đồng là cực dương.
b. Khi pin hoạt động thì khối lượng điện cực đồng giảm.
c. Sức điện động chuẩn của pin được tính bằng công thức
d. Sức điện động chuẩn của pin là 1,34V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02A. Cho biết Q = n.F = I.t, trong đó: Q là điện lượng, n là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (F = 96500 C.mol-1). Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là 268 giờ. (Kết quả làm tròn đến hàng đơn vị)
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 23. Cho các phát biểu sau:
(a) Cu2+ có tính oxi hóa mạnh hơn Fe3+ và Cu có tính khử mạnh hơn Fe2+.
(b) Zn có tính khử mạnh hơn Pb và Zn2+ có tính oxi hóa yếu hơn Pb2+.
(c) Những kim loại có thế điện cực chuẩn âm đều khử được H+ thành H2 và phản ứng được trong dung dịch HCl.
(d) Trong dãy hoạt động hóa học, những kim loại đứng trước có thế điện cực chuẩn lớn hơn thế điện cực chuẩn của những kim loại đứng sau.
(e) Kẽm có thể khử các ion Fe2+ và Ni2+ về kim loại Fe và Ni nhưng không thể khử ion Al3+ về kim loại Al.
Số phát biểu đúng là?
Câu 24. Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử Ni2+/Ni () và Cd2+/Cd (). Sức điện động chuẩn của pin điện hoá trên là bao nhiêu volt?
Câu 25. Hai cặp oxi hoá - khử Ni2+/Ni và Cd2+/Cd tạo thành pin có sức điện động chuẩn là 0,146 V. Phản ứng xảy ra trong pin:
Cd + Ni2+ ⟶ Cd2+ + Ni
Thế điện cực chuẩn của cặp Cd2+/Cd có giá trị là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm)
Cho biết: ở trạng thái chuẩn, pin Ni - Pb có sức điện động 0,131 V;
Câu 26. Cho các kim loại sau: Na, Ca, Fe, Al, Zn, Cu, Ag. Có bao nhiêu kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng?
Câu 27. Điện phân dung dịch CuCl2 trong 1 giờ với dòng điện 5A. Sau điện phân, dung dịch còn CuCl2 dư. Khối lượng Cu đã sinh ra tại cathode của bình điện phân là bao nhiêu gam? (Cho Cu = 64).
Câu 28. Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa [Ag(NH3)2]+ với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode: [Ag(NH3)2]+ + 1e → Ag + 2NH3.
- Điện lượng q = It = ne. F, F = 96 500 C/mol.
Giá trị của t là bao nhiêu? (Làm tròn kết quả đến phần mười).
................................
................................
................................
Xem thêm đề kiểm tra Hóa học lớp 12 Chân trời sáng tạo có đáp án hay khác:
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 1 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 2 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 3 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 4 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 6 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 7 (có lời giải)
Đề kiểm tra Hóa học 12 Chân trời sáng tạo Chương 8 (có lời giải)
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 12 Chân trời sáng tạo
- Giải SBT Hóa học 12 Chân trời sáng tạo
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST















 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

