C2H2 + HCl dư → C2H4Cl2
Phản ứng C2H2 + HCl dư (tỉ lệ 1 : 2) thuộc loại phản ứng cộng đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C2H2 có lời giải, mời các bạn đón xem:
C2H2 + 2HCl 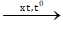 C2H4Cl2
C2H4Cl2
1. Phương trình phản ứng acetylene tác dụng với HCl
CH ≡ CH + 2HCl CH3 - CHCl2
2. Điều kiện của phản ứng
- Nhiệt độ cao 150 – 200°C.
- Xúc tác HgCl2.
3. Cách tiến hành phản ứng acetylene tác dụng với HCl
- Dẫn 2 khí C2H2 và HCl vào bình có xúc tác HgCl2 ở nhiệt độ cao (150 – 200°C).
4. Mở rộng về tính chất hoá học của alkyne
4.1. Phản ứng cộng
a) Cộng hiđro
- Khi có niken (hoặc platin hoặc palađi) làm xúc tác, alkyne cộng hiđro tạo thành alkene, sau đó tạo thành alkane.
Thí dụ:
CH ≡ CH + H2 CH2 = CH2
CH2 = CH2 + H2 CH3 – CH3
- Lưu ý: Khi dùng xúc tác là hỗn hợp Pd/PbCO3 hoặc Pd/BaSO4, alkyne chỉ cộng một phân tử hiđro tạo thành alkene.
CH ≡ CH + H2 CH2 = CH2
⇒ Đặc tính này được dùng để điều chế alkene từ alkyne.
b) Cộng brom, clo
- Brom và clo cũng tác dụng với alkyne theo hai giai đoạn liên tiếp.
Thí dụ:
CH ≡ CH + Br2 → CHBr = CHBr
CHBr = CHBr + Br2 → CHBr2 – CHBr2
c) Cộng HX (X là OH, Cl, Br, CH3COO...)
- alkyne tác dụng với HX theo hai giai đoạn liên tiếp.
Thí dụ:
CH ≡ CH + HCl CH2 = CHCl
CH2 = CHCl + HCl CH3 – CHCl2
- Khi có xúc tác thích hợp, alkyne tác dụng với HCl sinh ra dẫn xuất monochloro của alkene.
Thí dụ:
CH ≡ CH + HCl CH2 = CHCl
- Phản ứng cộng HX của các alkyne cũng tuân theo quy tắc Mac-côp-nhi-côp.
- Phản ứng cộng H2O của các alkyne chỉ xảy ra theo tỉ lệ số mol 1:1.
Thí dụ:
CH ≡ CH + H2O CH3 – CH = O (anehit axetic)
d) Phản ứng đime và trime hoá
2CH ≡ CH CH ≡ C – CH = CH2 (vinylacetylene)
3CH ≡ CH C6H6 (benzen)
4.2. Phản ứng thế bằng ion kim loại
- Sục khí acetylene vào dung dịch silver nitrate trong amonia, thấy có kết tủa vàng nhạt.
CH ≡ CH + 2AgNO3 + 2NH3 → Ag – C ≡ C – Ag↓ + 2NH4NO3
Phản ứng thế nguyên tử hidro của C2H2 bằng ion bạc
a) Trước khi sục khí C2H2.
b) Sau khi sục khí C2H2.
Kết luận:
- Nguyên tử hiđro liên kết trực tiếp với nguyên tử cacbon liên kết ba đầu mạch có tính linh động cao hơn các nguyên tử hiđro khác nên có thể bị thay thế bằng ion kim loại.
- Các ank-1-yne khác như propin, but-1-in, ... cũng có phản ứng tương tự acetylene.
⇒ Tính chất này được dùng để phân biệt ank-1-yne với alkene và các alkyne khác.
4.3. Phản ứng oxi hoá
a) Phản ứng oxi hoá hoàn toàn (cháy)
Các alkyne cháy toả nhiều nhiệt:
2CnH2n – 2 + (3n – 1)O2 2nCO2 + 2(n – 1)H2O
b) Phản ứng oxi hoá không hoàn toàn
- Tương tự alkene và alkadien, alkyne cũng có khả năng làm mất màu dung dịch thuốc tím.
5. Bài tập vận dụng liên quan
Câu 1: Hydrocarbon X ở điều kiện thường là chất khí. Khi oxi hoá hoàn toàn X thì thu được thể tích khí CO2 và hơi H2O là 2 : 1 ở cùng điều kiện. X phản ứng với dung dịch AgNO3 trong NH3 tạo kết tủa. Số cấu tạo của X thoả mãn tính chất trên là
A. 2.
B. 3.
C. 4.
D. 1.
Hướng dẫn giải:
Đáp án A
X thể khí → số C ≤ 4
Mà
Vì X phản ứng được với AgNO3/NH3 → có liên kết 3 đầu mạch
→ có 2 công thức cấu tạo thỏa mãn: C2H2 ; C4H4 (CH≡C – CH=CH2)
Câu 2:Hidrat hóa có xúc tác 3,36 lit C2H2(dktc) thu được hỗn hợp A (hiệu suất phản ứng 60%). Cho hỗn hợp A tác dụng với AgNO3/NH3 thu được m gam kết tủa. Giá trị của m là :
A. 48,24
B.33,84
C.14,4
D.19,44
Hướng dẫn giải:
Đáp án B
C2H2 + H2O CH3CHO
C2H2 Ag2C2 ↓
CH3CHO 2Ag ↓
Câu 3: Khi điều chế acetylene bằng phương pháp nhiệt phân nhanh CH4 thu được hỗn hợp A gồm acetylene, hiđro và một phần methane chưa phản ứng. Tỷ khối hơi cuả A so với hiđro bằng 5. Hiệu suất chuyển hóa methane thành acetylene là
A. 60%
B. 50%.
C. 40%.
D. 80%.
Hướng dẫn giải:
Đáp án A
Xét 1 mol CH4
2CH4 C2H2 + 3H2
x → 0,5x → 1,5x mol
→ Sau phản ứng : nhh = 1-x + 0,5x + 1,5x = 1 + x (mol)
Bảo toàn khối lượng : mtrước = msau
→ 16.1 = 5.2.(1 + x)
→ x = 0,6 mol
→ H = 60%
Câu 4: Trong phân tử alkyne X, hidro chiếm 11,76% khối lượng. Công thức phân tử của X là :
A. C2H2
B. C5H8
C. C4H6
D. C3H4
Hướng dẫn giải:
Đáp án B
Công thức alkyne là CnH2n-2 (n ≥ 2)
→ n = 5
Vậy X là C5H8
Câu 5: Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm etan, propan, propilen, acetylene thu được số mol H2O ít hơn số mol CO2 là 0,02 mol. Mặt khác 0,1 mol X có thể làm mất màu tối đa m gam dung dịch Br2 16%. Giá trị của m là
A. 180
B. 120
C. 100
D.60
Hướng dẫn giải:
Đáp án B
Gọi số mol alkane là a, alkene là b, alkyne là c
→ a + b + c = 0,1
Mà
→ b + 2c = a+ b+ c + c – a = 0,1 + 0,02 = 0,12 mol
→ 0,12.160 = 19,2 gam.
→ m = 120g
Câu 6: Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hydrocarbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo trong cùng điều kiện nhiệt độ và áp suất). Công thức phân tử của X là
A. C2H4.
B. CH4.
C. C2H6.
D. C3H8.
Hướng dẫn giải:
Đáp án C
Ta có: hydrocarbon X cũng có 2C.
Hydrocarbon X có số H lớn hơn 4
→ có số H = 6
→ X là C2H6
Câu 7:Một hỗn hợp X gồm 0,14 mol acetylene, 0,1 mol vinylacetylene, 0,2 mol H2 và một ít bột Ni trong bình kín. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hydrocarbon. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3 dư/NH3, thu được m gam kết tủa vàng nhạt và 3,136 lít hỗn hợp khí Z (đktc) gồm 5 hydrocarbon thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp khí Z cần vừa đủ 120 ml dung dịch Br2 1M. Giá trị của m gần nhất với giá trị nào sau đây?
A. 25
B. 20
C. 34
D. 24
Hướng dẫn giải:
Đáp án B
∑nπ bđ = 0,14.2 + 0,1.3 = 0,58 mol
→ n lk π sau pư hidro hóa = 0,58 – 0,2 = 0,38 mol
nhh khí có lk 3 đầu mạch bị giữ lại : 0,14 + 0,1 – nZ = 0,1 mol (I)
n lk π trong hh Z = 0,12 mol (II)
→ Số mol π đã biết = 2.n π(I) + nπ(II) = 0,32 mol ≠ n π thực tế = 0,38 mol
→ Trong 2 hợp chất bị AgNO3/ NH3 giữ lại chứa CH≡C – CH = CH2 dư
dư = 0,38 – 0,32 = 0,06 mol
Vì ∑n khí có liên kết ba = 0,1 mol → khí còn lại phải là C2H2 : 0,04 mol (Nếu là C4H6 thì Y không thể chứa tới 7 HC)
→ m↓ = = 0,04. 240 + 0,06. 159 =19,14 g ≈ 20 g
Câu 8:alkyne C6H10 có bao nhiêu đồng phân phản ứng với dung dịch AgNO3/NH3 ?
A. 3
B. 4
C. 5
D. 6
Hướng dẫn giải:
Đáp án B
CH≡C-CH2-CH2-CH2-CH3
CH≡C-CH2-CH(CH3)-CH3
CH≡C-CH(CH3)-CH2-CH3
CH≡C-C(CH3)3
Vậy có 4 đồng phân thỏa mãn đề bài.
Câu 9: Đốt cháy 3,4 gam hydrocarbon A tạo ra 11g CO2. Mặt khác, khi cho 3,4g A tác dụng với lượng dư dung dịch AgNO3 trong NH3 thấy tạo thành a gam kết tủa. CTPT của A và a là:
A. C2H2; 8,5g
B. C3H4; 8,5g
C. C4H6; 8,75g
D. C5H8; 8,75g
Hướng dẫn giải:
Đáp án D
Do A tác dụng được với AgNO3 trong NH3 nên A là ank-1-in:
CnH2n-2 + (1,5n – 0,5) O2 nCO2 + (n-1)H2O
0,25 mol
Ta có:
→ CTPT A là C5H8
C5H8 + AgNO3 + NH3 C5H7Ag + NH4NO3
0,05 mol 0,05 mol
→ a = 0,05.175 = 8,75g
Câu 10: Hỗn hợp ban đầu gồm 1 alkyne, 1 alkene, 1 alkane và H2 với áp suất 4 atm. Đun nóng bình với Ni xúc tác để thực hiện phản ứng cộng sau đó đưa bình về nhiệt độ ban đầu được hỗn hợp Y, áp suất hỗn hợp Y là 3 atm. Tỉ khối hỗn hợp X và Y so với H2 lần lượt là 24 và x. Giá trị của x là
A. 18.
B. 34.
C. 24.
D. 32.
Hướng dẫn giải:
Đáp án D
Do nhiệt độ và thể tích bình không thay đổi
Giả sử nX = 4 → nY = 3
mX = 4.24.2 = 192 = mY
→ MY = = 64
→ x = 32
Câu 11: Hỗn hợp A gồm H2, C3H8, C3H4. Cho từ từ 12 lít A qua bột Ni xúc tác. Sau phản ứng được 6 lít khí duy nhất (các khí đo ở cùng điều kiện). Ti khối hơi của A so với H2 là
A. 11.
B. 22.
C. 26.
D. 13.
Hướng dẫn giải:
Đáp án A
Khí duy nhất là C3H8.
BTKL: mđ = ms → nđ.Mđ = ns.Ms
→ Mđ = = 22
= 11
Câu 12: Dẫn hỗn hợp X gồm 0,05 mol C2H2, 0,1 mol C3H4 và 0,1 mol H2 qua ống chứa Ni nung nóng một thời gian thu được hỗn hợp Y gồm 7 chất. Đốt cháy hoàn toàn Y bằng O2 dư rồi cho sản phẩm cháy hấp thụ hết vào 700 ml dung dịch NaOH 1M, thu được dung dịch Z. Tổng khối lượng chất tan trong Z là
A. 35,8
B. 45,6
C. 38,2
D. 40,2
Hướng dẫn giải:
Đáp án D
Đốt cháy Y cũng là cháy X
BTNT “C” →
Lại có:
→ tạo 2 muối Na2CO3 và NaHCO3
Trong đó = 0,3 mol
→
m chất tan trong Z = 0,3.106 + 0,1.84 = 40,2g
Xem thêm các phương trình hóa học hay khác:
- C2H2 + H2 → C2H4
- C2H2 + 2H2 → C2H6
- C2H2 + Br2 → C2H2Br2
- C2H2 + 2Br2 → C2H2Br4
- C2H2 + H2O → CH3CHO
- 2CH≡CH → CH≡CH-CH=CH2 ( vinyl acetylene )
- 3CH≡CH → C6H6 ( benzene )
- nCH≡CH → (-CH=CH-)n (nhựa cupren)
- CH≡CH + 2AgNO3 + 2NH3 → Ag–C≡C-Ag ↓ + 2NH4NO3
- 2C2H2 + 5O2 → 4CO2 + 2H2O
- 3C2H2 + 8KMnO4 → 3(COOK)2 + 8MnO2 ↓ + 2KOH + 2H2O
- C2H2 + Cl2 → C2H2Cl2
- C2H2 + Cl2 → 2C + 2HCl
- C2H2 + HBr → C2H3Br
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)








 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



