Phân tử khối của Bilirubin (chính xác nhất)
Phân tử khối của Bilirubin (công thức phân tử là: C33H36N4O6) có phân tử khối là 584. Bài viết dưới đây giúp bạn hiểu rõ hơn về cách tính phân tử khối của Bilirubin. Mời các bạn đón đọc.
Phân tử khối của Bilirubin (chính xác nhất)
1. Bilirubin là gì?
- Bilirubin là một sắc tố màu vàng được tạo ra từ sự phân hủy của hemoglobin trong hồng cầu. Đây là một hợp chất hữu cơ phức tạp, không tan trong nước, được bài tiết qua mật và nước tiểu, và nồng độ cao có thể biểu hiện một số bệnh nhất định. Nó chịu trách nhiệm cho màu vàng của vết bầm tím và sự đổi màu vàng trong vàng da. Bilirubin có công thức phân tử là C33H36N4O6.
- Bilirubin có phân tử khối M = 584.
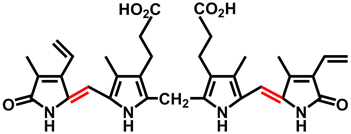
- Công thức cấu tạo của bilirubin:
2. Cách tính phân tử khối của bilirubin
- Phân tử khối của bilirubin là 584. Cách tính như sau:
= 33.MC + 36.MH + 4.MN + 6.MO = 33.12 + 36.1 + 4.14 + 6.16 = 584.
3. Phân tử khối là gì?
- Phân tử khối là khối lượng tương đối của một phân tử.
- Phân tử khối của một chất bằng tổng nguyên tử khối của các nguyên tử trong phân tử chất đó.
Ví dụ:
Phân tử khối của khí nitrogen (N2) bằng: 14.2 = 28.
Phân tử khối của đường (C12H22O11) bằng: 12.12 + 1.22 + 16.11 = 342.
4. Bài tập minh họa
Câu 1: Công thức phân tử của bilirubin là
A. C12H22O11.
B. C6H6O.
C. C15H16O2.
D. C8H10O.
Lời giải:
Đáp án đúng là: C
Câu 2: Bilirubin là sản phẩm chuyển hóa từ
A. Insulin.
B. Chất béo.
C. Hemoglobin.
D. Vitamin D.
Lời giải:
Đáp án đúng là: C
Câu 3: Bilirubin có phân tử khối là
A. 550.
B. 472.
C. 584.
D. 600.
Lời giải:
Đáp án đúng là: C
Xem thêm phân tử khối của các chất hóa học hay khác:
- Phân tử khối của Bisphenol A
- Phân tử khối của Cellobiose
- Phân tử khối của Cloramin (chloramine)
- Phân tử khối của Creatinin
- Phân tử khối của Cyanohydrin
- Phân tử khối của Cyclohexanone
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Wiki tính chất hóa học trình bày toàn bộ tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

