K + H2O → KOH + H2
Phản ứng K + H2O ra KOH và H2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về K có lời giải, mời các bạn đón xem:
2K + 2H2O → 2KOH + H2
1. Phương trình hoá học của phản ứng K tác dụng với H2O
2K + 2H2O → 2KOH + H2
Cách lập phương trình hoá học theo phương pháp thăng bằng electron:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử: K; chất oxi hoá: H2O
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2K + 2H2O → 2KOH + H2
2. Điều kiện để K tác dụng với H2O
Phản ứng giữa K tác dụng với H2O diễn ra ở nhiệt độ thường.
3. Cách tiến hành thí nghiệm
Cho mẩu nhỏ kali vào cốc nước.
4. Hiện tượng phản ứng
Kali (K) màu trắng bạc phản ứng mạnh với nước và xuất hiện bọt khi do hiđro (H2) được giải phóng. Sau phản ứng thu được dung dịch kiềm, làm quỳ tím chuyển sang màu xanh.
5. Mở rộng kiến thức về kim loại kiềm
5.1. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Kim loại kiềm thuộc nhóm IA của bảng tuần hoàn, gồm các nguyên tố: Liti (Li); natri (Na); kali (K); rubiđi (Rb); xesi (Cs) và franxi (Fr).
Trong đó Fr là nguyên tố phóng xạ.
- Cấu hình electron nguyên tử:
Li: [He]2s1; Na: [Ne]3s1;
K: [Ar]4s1; Rb: [Kr]5s1;
Cs: [Xe]6s1
⇒ Nguyên tử kim loại kiềm có 1e ở lớp ngoài cùng.
5.2. Tính chất vật lí
- Các kim loại kiềm có màu trắng bạc và có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy, nhiệt độ sôi thấp, khối lượng riêng nhỏ và độ cứng thấp.
- Kim loại kiềm nhiệt độ nóng chảy, nhiệt độ sôi thấp, khối lượng riêng nhỏ và độ cứng thấp do:
+ Kim loại kiềm có cấu tạo tinh thể lập phương tâm khối, cấu trúc tương đối rỗng.
+ Trong tinh thể, các nguyên tử và ion liên kết với nhau bằng liên kết kim loại yếu.
5.3. Tính chất hóa học
- Các kim loại kiềm có tính rất khử mạnh: M → M+ + 1e. Tính khử tăng dần từ Li đến Cs.
- Trong hợp chất, các kim loại kiềm có số oxi hóa +1.
a. Tác dụng với phi kim
Kim loại kiềm khử dễ dàng các nguyên tử phi kim thành ion âm.
Ví dụ:
+ Na tác dụng với oxi khô tạo peoxit:
2Na + O2 → Na2O2 (natri peoxit)
+ Na tác dụng với oxi không khí khô ở nhiệt độ phòng tạo Na2O.
4Na + O2 → 2Na2O (sodium oxide)
+ Na nóng chảy tác dụng với Cl2 tạo thành sodium chloride:
2Na + Cl2 → 2NaCl
b. Tác dụng với axit
- Kim loại kiềm khử mạnh ion H+ trong dung dịch axit HCl và H2SO4 loãng thành khí H2:
2M + 2H+ → 2M+ + H2 ↑ (với M là kim loại kiềm)
- Phản ứng xảy ra mãnh liệt, tất cả các kim loại kiềm đều nổ khi tiếp xúc với axit.
c. Tác dụng với nước
- Kim loại kiềm khử nước dễ dàng ở nhiệt độ thường, giải phóng khí H2:
2M + 2H2O → 2MOH (dd) + H2 ↑ (với M là kim loại kiềm)
- Từ Li đến Cs phản ứng với nước xảy ra càng mãnh liệt. Do đó để bảo quản kim loại kiềm, người ta ngâm chìm các kim loại kiềm trong dầu hỏa.
5.4. Ứng dụng, trạng thái tự nhiên và điều chế
a. Ứng dụng
Kim loại kiềm có nhiều ứng dụng quan trọng:
- Dùng chế tạo hợp kim có nhiệt độ nóng chảy thấp.
- Cs dùng chế tạo tế bào quang điện.
- Hợp kim liti – nhôm siêu nhẹ được dùng trong kĩ thuật hàng không.
b. Trạng thái tự nhiên
Trong tự nhiên kim loại kiềm không có ở dạng đơn chất mà chỉ tồn tại ở dạng hợp chất.
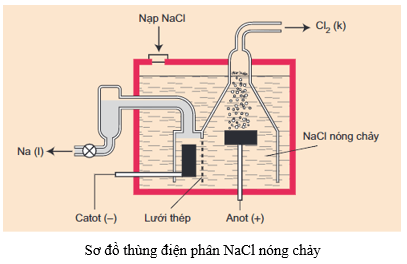
c. Điều chế
- Phương pháp: Điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
- Ví dụ:
2NaCl 2Na + Cl2
6. Bài tập vận dụng liên quan
Câu 1: Khi cho kim loại Na vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dung dịch trong suốt.
D. Chỉ có sủi bọt khí.
Hướng dẫn giải
Đáp án B
Ban đầu xuất hiện bọt khí do Na phản ứng với nước
2Na + 2H2O → 2NaOH + H2
Sau đó xuất hiện kết tủa xanh Cu(OH)2
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Câu 2: Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thuộc nhóm nào?
A. IA B. IIIA C. IVA D. IIA
Hướng dẫn giải:
Đáp án A
Kim loại kiềm là các kim loại thuộc nhóm IA trong bảng tuần hoàn nguyên tố hóa học
Gồm: Li, Na, K, Rb, Cs, Fr
Câu 3: Kim loại nào sau đây là kim loại kiềm?
A. Al B. Na C. Ca D. Fe
Hướng dẫn giải:
Đáp án B
Kim loại kiềm là các kim loại thuộc nhóm IA trong bảng tuần hoàn nguyên tố hóa học
Gồm: Li, Na, K, Rb, Cs, Fr
Câu 4: Phương pháp điều chế kim loại kiềm là:
A.Khử oxit kim loại kiềm bằng chất khử CO.
B.Điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
C.Điện phân dung dịch muối halogenua.
D.Cho Al tác dụng với dung dịch muối của kim loại kiềm.
Hướng dẫn giải
Đáp án B
Kim loại kiềm được điều chế bằng cách điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
2RX 2R + X2
Trong đó X là nguyên tử halogen
4ROH 4R + O2 + 2H2O
Câu 5: Phát biểu nào sau đây là đúng?
A. Trong hợp chất, tất cả các kim loại kiềm đều có số oxi hóa +1.
B. Tất cả các kim loại nhóm IIA đều có mạng tinh thể lập phương tâm khối.
C. Tất cả các hiđroxit của kim loại nhóm IIA đều dễ tan trong nước.
D. Trong nhóm IA, tính khử của các kim loại giảm dần từ Li dến Cs.
Hướng dẫn giải:
Đáp án A
A. Đúng.
B. Sai. Trong nhóm IIA: Be và Mg có mạng tinh thể lục phương; Ca và Sr có mạng tinh thể lập phương tâm diện; Ba có mạng lập phương tâm khối.
C. Sai. Be(OH)2, Mg(OH)2 kết tủa.
D. Sai. Trong nhóm IA, tính khử tăng dần từ Li đến Cs
Câu 6: Cho các phát biểu sau về ứng dụng của kim loại kiềm:
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là
A.1. B. 2. C. 3. D.4
Hướng dẫn giải:
Đáp án C
Phát biểu (1), (2), (3) đúng.
Câu 7: Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau:
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn giải
Đáp án D
Cả 4 dự đoán đều đúng.
- Chiếc thuyền làm bằng giấy thấm nước làm cho mẩu Na phản ứng với nước.
Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
- Khí H2 sinh ra đẩy mẩu Na cũng như đẩy chiếc thuyền chạy vòng quanh chậu nước.
- Phản ứng trên tỏa nhiều nhiệt khiến cho chiếc thuyền bốc cháy, mẩu Na nóng chảy và vo tròn lại (do sức căng bề mặt).
- Vì NaOH là dung dịch bazơ → Nhỏ phenolphtalein làm dung dịch chuyển màu hồng.
Câu 8: Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %. B. 10,09%. C. 13,13%. D. 55,33%.
Hướng dẫn giải
Đáp án A
= 0,08 mol
Gọi công thức chung của hai kim loại kiềm là M
2M + 2H2O → 2MOH + H2
nM = 2. = 2.0,08 = 0,16 mol
→ MM = = 21
→ Li (MLi = 7) < 21 < K (MK = 39)
→ Kim loại A là Li
→
%mLi =
Câu 9: Kim loại nào sau đây được dùng chế tạo tế bào quang điện?
A. Na. B. Cs. C. Li. D. K.
Hướng dẫn giải
Đáp án B
Cs được dùng để chế tạo tế bào quang điện
Câu 10: Để bảo quản kim loại kiềm người ta làm bằng cách nào?
A. Để trong lọ kín B. Ngâm trong dầu hỏa
C. Ngâm trong nước D. Để trong lọ thủy tinh
Hướng dẫn giải
Đáp án B
Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa
Câu 11: Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần ba dung dịch A là
A. 100 ml. B. 200 ml. C. 300 ml. D. 600 ml.
Hướng dẫn giải
Đáp án A
= 0,03 mol
mol
→ VHCl = lít = 100 ml
Câu 12: Cấu hình electron lớp ngoài cũng của nguyên tử kim loại kiềm là
A. ns2 B. ns2np1 C. ns1 D. ns2np2
Hướng dẫn giải
Đáp án C
Kim loại kiềm thuộc nhóm IA.
Các kim loại kiềm đề có 1 electron lớp ngoài cùng và có cấu hình electron chung lớp ngoài cùng là ns1 (n là số thứ tự chu kì).
Xem thêm các phương trình hóa học hay khác:
- 2K + Cl2 → 2KCl
- 2K + Br2 → 2KBr
- 2K + I2 → 2KI
- 4K + O2 → 2K2O
- 2K + S → 2K2S
- K + 2HCl → KCl + H2
- K + 2H2SO4 → K2SO4 + H2
- 6K + 2H3PO4 → 2K3PO4 + 3H2
- 2K + H3PO4 → K2HPO4 + H2
- 2K + 2H3PO4 → 2KH2PO4 + H2
- 2K + 2HF → 2KF + H2
- 2K + CuSO4 + 2H2O → K2SO4 + H2 + Cu(OH)2
- 2K + FeSO4 + 2H2O → K2SO4 + H2 + Fe(OH)2
- 6K + Al2(SO4)3 + 6H2O → 3K2SO4 + H2 + 2Al(OH)3
- 2K + ZnSO4 + 2H2O → K2SO4 + H2 + Zn(OH)2
- 2K + PbSO4 + 2H2O → 3K2SO4 + H2 + Pb(OH)2
- 6K + Fe2(SO4)3 + 6H2O → 3K2SO4 + H2 + 2Fe(OH)3
- 2K + CuCl2 + 2H2O → 2KCl + H2 + Cu(OH)2
- 2K + FeCl2 + 2H2O → 2KCl + H2 + Fe(OH)2
- 6K + 2AlCl3 + 6H2O → 6KCl + 3H2 + 2Al(OH)3
- 2K + ZnCl2 + 2H2O → 2KCl + H2 + Zn(OH)2
- 3K + 2FeCl3 + 3H2O → 6KCl + 3H2 + 2Fe(OH)3
- 6K + Cr2(SO4)3 + 6H2O → 3K2SO4 + H2 + 2Cr(OH)3
- 6K + 2CrCl3 + 6H2O → 6KCl + 3H2 + 2Cr(OH)3
- 2K + Cu(NO3)2 + 2H2O → 2KNO3 + H2 + Cu(OH)2
- 2K + Fe(NO3)2 + 2H2O → 2KNO3 + H2 + Fe(OH)2
- 6K + 2Al(NO3)3 + 6H2O → 6KNO3 + 3H2 + 2Al(OH)3
- 2K + Zn(NO3)2 + 2H2O → 2KNO3 + H2 + Zn(OH)2
- 2K + Pb(NO3)2 + 2H2O → 2KNO3 + H2 + Pb(OH)2
- 6K + 2Fe(NO3)3 + 6H2O → 6KNO3 + 3H2 + 2Fe(OH)3
- 2K + 2C2H5OH → 2C2H5OK + H2
- 2K + 2CH3OH → 2CH3OK + H2
- 2K + 2CH3COOH → 2CH3COOK + H2
- 2K + 2C6H5OH → 2C6H5OK + H2
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



