KOH + Cl2 → KCl + KClO + H2O | KOH ra KCl | KOH ra KClO | Cl2 ra KCl | Cl2 ra KClO
Phản ứng KOH + Cl2 hay KOH ra KCl hoặc KOH ra KClO hoặc Cl2 ra KCl hoặc Cl2 ra KClO thuá»c loại phản ứng oxi hóa khá» Äã Äược cân bằng chÃnh xác và chi tiết nhất. Bên cạnh Äó là má»t sá» bà i táºp có liên quan vá» KOH có lá»i giải, má»i các bạn Äón xem:
2KOH + Cl2 → KCl + KClO + H2O
Äiá»u kiá»n phản ứng
- Phản ứng xảy ra ngay Äiá»u kiá»n thÆ°á»ng.
Cách thá»±c hiá»n phản ứng
- Dẫn khà Cl2 và o á»ng nghiá»m chứa dung dá»ch KOH có chứa mà u quỳ tÃm.
Hiá»n tượng nháºn biết phản ứng
- Ban Äầu mẩu quỳ có mà u xanh, sau khi phản ứng xảy ra mà u quỳ bá» mất.
Bạn có biết
- KClO có tÃnh oxi hóa mạnh, có thá» tẩy mà u và tiêu diá»t vi khuẩn.
Và dụ minh há»a
ViÌ duÌ£ 1:
KOH không thá» phản ứng vá»i khà nà o sau?
A. SO2. B. CO2. C. Cl2. D. O2.
HÆ°á»ng dẫn giải
KOH không thá» phản ứng vá»i O2.
Äáp án D.
ViÌ duÌ£ 2:
Chất nà o sau Äây có tÃnh tẩy mà u?
A. KCl. B. NaCl. C. KClO. D. MgCl2.
HÆ°á»ng dẫn giải
KClO có tÃnh tẩy mà u.
Äáp án C.
ViÌ duÌ£ 3:
Thá» tÃch khà Clo á» Äktc cần dùng Äá» phản ứng vừa Äủ vá»i 100ml KOH 1M á» Äiá»u kiá»n thÆ°á»ng lÃ
A. 1,12 lÃt. B. 2,24 lÃt. C. 3,36 lÃt. D. 4,48 lÃt.
HÆ°á»ng dẫn giải
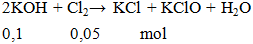
V = 0,05.22,4 =1,12 lÃt.
Äáp án A.
Xem thêm các phÆ°Æ¡ng trình hóa há»c hay khác:
- 2KOH + CO2 → K2CO3 + H2O
- KOH + CO2 → KHCO3
- 2KOH + SO2 → K2SO3 + H2O
- KOH + SO2 → KHSO3
- KOH + HCl → KCl + H2O
- KOH + HNO3 → KNO3 + H2O
- 2KOH + H2SO4 → K2SO4+ 2H2O
- 2KOH + CuSO4 → K2SO4+ Cu(OH)2
- 2KOH + FeSO4 → K2SO4+ Fe(OH)2
- 3KOH + FeCl3 → 3KCl+ Fe(OH)3
- 2KOH + Mg(NO3)2 → 2KNO3+ Mg(OH)2
- KOH + Al(OH)3 → KAlO2+ 2H2O
- KOH + Cr(OH)3 → KCrO2+ 2H2O
- 2KOH + Zn(OH)2 → K2ZnO2+ 2H2O
- KOH + KHCO3 → K2CO3 + H2O
- KOH + KHSO3 → K2SO3 + H2O
- 2KOH + Ba(HSO3)2 → K2SO3 + BaSO3 + 2H2O
- 2KOH + Ba(HCO3)2 → K2CO3 + BaCO3 + 2H2O
- 2KOH + Ca(HCO3)2 → K2CO3 + CaCO3 + 2H2O
- 2KOH + Ca(HSO3)2 → K2SO3 + CaSO3 + 2H2O
- 6KOH + 3Cl2 -90oC→ 5KCl + KClO3 + 3H2O
- 2KOH + Al2O3 → 2KAlO2 + H2O
- 2KOH + ZnO → K2ZnO2 + H2O
- 2KOH + H2S → K2S + 2H2O
- KOH + H2S → KHS + H2O
- KOH + CH3COOH → CH3COOK + H2O
- KOH + NH4Cl -to→ KCl+ NH3 + H2O
- KOH + NH4NO3 -to→ KNO3+ NH3 + H2O
- 2KOH + (NH4)2SO4 -to→ K2SO4+ 2NH3 + 2H2O
- CH3COOCH3 + KOH -H2O,to→ CH3COOK + CH3OH
- CH3COOC2H5 + KOH -H2O,to→ CH3COOK + C2H5OH
- C2H5Cl + KOH -to→ KCl + C2H5OH
- C2H5Br + KOH -to→ KBr + C2H5OH
- C2H5Br + KOH -toC2H5OH→ KBr + C2H4 + H2O
- C2H5Cl + KOH -toC2H5OH→ KCl + C2H4 + H2O
- C6H5OH + KOH → C6H5OK + H2O
- 2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
- Zn + 2KOH -to→ K2ZnO2 + H2
- KOH + KHS → K2S + H2O
- 2KOH + 2NaHS → K2S + Na2S + 2H2O
- 2KOH + 2NaHSO3 → K2SO3 + Na2SO3 + 2H2O
- 2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



