KOH + H2SO4 → K2SO4+ H2O
Phản ứng KOH + H2SO4 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về KOH có lời giải, mời các bạn đón xem:
2KOH + H2SO4 → K2SO4+ 2H2O
1. Phương trình phản ứng H2SO4 với KOH ra K2SO4
2KOH + H2SO4 → K2SO4 + 2H2O
Phản ứng này còn được gọi là phản ứng trung hoà.
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Mở rộng kiến thức H2SO4
3.1. Tính chất vật lí
- Axit sunfuric (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3).
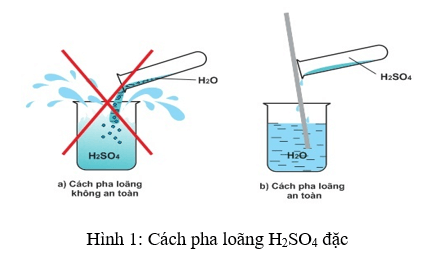
- H2SO4 tan vô hạn trong nước và toả nhiệt rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm.
- Cách pha loãng axit sunfuric đặc an toàn: Rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không được làm ngược lại.
3.2. Tính chất hóa học
a. Tính chất của dung dịch axit sunfuric loãng
H2SO4 loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
Ví dụ:
H2SO4 (loãng) + Mg → MgSO4 + H2 (↑)
3H2SO4 (loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
Chú ý: Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với H2SO4 loãng.
Khi Fe tác dụng với H2SO4 loãng, sản phẩm thu được là muối sắt (II)
H2SO4 (loãng) + Fe → FeSO4 + H2 (↑)
- Tác dụng với bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
- Tác dụng với basic oxide tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + CuO → CuSO4 + H2O
H2SO4 + Na2O → Na2SO4 + H2O
- Tác dụng với một số muối tạo thành muối sunfat và axit mới
Ví dụ:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
b. Tính chất của axit sunfuric đặc
- Tính oxi hóa mạnh
+ Axit sunfuric đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại khử mạnh như Mg).
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 CuSO4 + SO2 + 2H2O
Chú ý: Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội.
+ Tác dụng với nhiều phi kim:
C + 2H2SO4 CO2 + 2SO2 + 2H2O
S + 2H2SO4 3SO2 + 2H2O
+ Tác dụng với nhiều hợp chất có tính khử:
2FeO + 4H2SO4 Fe2(SO4)3 + SO2 + 4H2O
2KBr + 2H2SO4 Br2 + SO2 + 2H2O + K2SO4
Ngoài ra H2SO4 đặc có tính háo nước:
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O
3.3. Ứng dụng
- Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4.
- Axit sunfuric được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ...
3.4. Sản xuất
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính:
- Sản xuất sulfur dioxide (SO2)
Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2...
+ Đốt cháy lưu huỳnh: S + O2 SO2
+ Đốt quặng pirit sắt FeS2: 4FeS2 + 11O2 2Fe2O3 + 8SO2
- Sản xuất sulfur trioxide (SO3)
Oxi hoá SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 - 5000C, xúc tác V2O5:
2SO2 + O2 2SO3
- Hấp thụ SO3 bằng H2SO4
Dùng H2SO4 98% hấp thụ SO3, được oleum H2SO4 .nSO3:
H2SO4 + nSO3 → H2SO4 .nSO3
Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4 .nSO3 + nH2O → (n + 1) H2SO4
4. Bài tập vận dụng liên quan
Câu 1. Dãy kim loại nào sau phản ứng được với dung dịch H2SO4 loãng là:
A. Cu, Fe, Zn
B. Zn, Ag, Fe
C. Ag, Fe, Zn
D. Al, Fe, Zn
Hướng dẫn giải
Đáp án D
Dãy kim loại nào sau phản ứng được với dung dịch H2SO4 loãng là:
Al, Fe, Zn
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Zn + H2SO4→ ZnSO4+ H2
Fe + H2SO4 → FeSO4+ H2
Câu 2. Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl.
B. KOH + NH4Cl → KCl + NH3 + H2O.
C. 2NaOH + H2SO4→ Na2SO4 + 2H2O.
D. NaOH + NaHCO3 → Na2CO3 + H2O.
Hướng dẫn giải
Đáp án C
OH– + H+ → H2O
A. 2OH– + Fe2+ → Fe(OH)2
B. OH– + NH4+ → NH3 + H2O
C. OH– + H+ → H2O
D. OH– + HCO3– → CO32– + H2O
Câu 3. Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. rót từng giọt nước vào axit.
B. rót từng giọt axit vào nước.
C. cho cả nước và axit vào cùng một lúc.
D. cả 3 cách trên đều được.
Hướng dẫn giải
Đáp án B
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách: rót từng giọt axit vào nước.
Câu 4. Cho các chất sau: NaOH, Cu, CaO, Mg, NaCl. Chất nào phản ứng được với dung dịch axit sunfuric loãng?
A. NaOH, CaO, Mg
B. NaOH
C. Mg
D. NaCl.
Hướng dẫn giải
Đáp án A
2NaOH + H2SO4 → Na2SO4 + 2H2O
CaO + H2SO4 → CaSO4 + H2O
Mg + H2SO4 → MgSO4 + H2
Câu 5. Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
A. Barium oxide và axit sunfuric loãng
B. Bari hiđroxit và axit sunfuric loãng
C. Bari carbonate và axit sunfuric loãng
D. Bari clorua và axit sunfuric loãng
Hướng dẫn giải
Đáp án C
BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Câu 6. Trung hoà 150ml dung dịch H2SO4 1M bằng V ml dung dịch KOH. Giá trị của V là
A. 200 ml
B. 250 ml
C. 300 ml
D. 350 ml
Hướng dẫn giải
Đáp án C
H2SO4 + 2KOH → K2SO4 + 2H2O.
Có = CM. V = 1. 0,15 = 0,15 mol
→ nKOH = 2 = 2. 0,15 = 0,3 (mol)
→ VKOH = = 0,3 lít = 300 ml
Xem thêm các phương trình hóa học hay khác:
- 2KOH + CO2 → K2CO3 + H2O
- KOH + CO2 → KHCO3
- 2KOH + SO2 → K2SO3 + H2O
- KOH + SO2 → KHSO3
- KOH + HCl → KCl + H2O
- KOH + HNO3 → KNO3 + H2O
- 2KOH + CuSO4 → K2SO4+ Cu(OH)2
- 2KOH + FeSO4 → K2SO4+ Fe(OH)2
- 3KOH + FeCl3 → 3KCl+ Fe(OH)3
- 2KOH + Mg(NO3)2 → 2KNO3+ Mg(OH)2
- KOH + Al(OH)3 → KAlO2+ 2H2O
- KOH + Cr(OH)3 → KCrO2+ 2H2O
- 2KOH + Zn(OH)2 → K2ZnO2+ 2H2O
- KOH + KHCO3 → K2CO3 + H2O
- KOH + KHSO3 → K2SO3 + H2O
- 2KOH + Ba(HSO3)2 → K2SO3 + BaSO3 + 2H2O
- 2KOH + Ba(HCO3)2 → K2CO3 + BaCO3 + 2H2O
- 2KOH + Ca(HCO3)2 → K2CO3 + CaCO3 + 2H2O
- 2KOH + Ca(HSO3)2 → K2SO3 + CaSO3 + 2H2O
- 2KOH + Cl2 → KCl + KClO + H2O
- 6KOH + 3Cl2 -90oC→ 5KCl + KClO3 + 3H2O
- 2KOH + Al2O3 → 2KAlO2 + H2O
- 2KOH + ZnO → K2ZnO2 + H2O
- 2KOH + H2S → K2S + 2H2O
- KOH + H2S → KHS + H2O
- KOH + CH3COOH → CH3COOK + H2O
- KOH + NH4Cl -to→ KCl+ NH3 + H2O
- KOH + NH4NO3 -to→ KNO3+ NH3 + H2O
- 2KOH + (NH4)2SO4 -to→ K2SO4+ 2NH3 + 2H2O
- CH3COOCH3 + KOH -H2O,to→ CH3COOK + CH3OH
- CH3COOC2H5 + KOH -H2O,to→ CH3COOK + C2H5OH
- C2H5Cl + KOH -to→ KCl + C2H5OH
- C2H5Br + KOH -to→ KBr + C2H5OH
- C2H5Br + KOH -toC2H5OH→ KBr + C2H4 + H2O
- C2H5Cl + KOH -toC2H5OH→ KCl + C2H4 + H2O
- C6H5OH + KOH → C6H5OK + H2O
- 2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
- Zn + 2KOH -to→ K2ZnO2 + H2
- KOH + KHS → K2S + H2O
- 2KOH + 2NaHS → K2S + Na2S + 2H2O
- 2KOH + 2NaHSO3 → K2SO3 + Na2SO3 + 2H2O
- 2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



